题目内容
3.将一定量的氯气通入200 mL的KBr溶液中,充分反应后将溶液蒸干,得到38.7g干燥的固体物质.经测定该固体物质中K+与Br-的物质的量之比为2:1.(1)计算通入的氯气在标准状况下的体积.
(2)计算原KBr溶液的物质的量浓度.
分析 由方程式2KBr+Cl2=2KCl+Br2,K+与Br-的物质的量之比为2:1 说明Br-被氧化了一半,剩余固体中KBr和KCl的物质的量相等,由此分析解答.
解答 解:由方程式2KBr+Cl2=2KCl+Br2,K+与Br-的物质的量之比为2:1 说明Br-被氧化了一半,剩余固体中KBr和KCl的物质的量相等,设KBr和KCl的物质的量为n,则(119+74.5)n=38.7,解之得n=0.2mol,所以通入氯气的物质的量为0.1mol,所以原KBr的物质的量0.4mol,
(1)通入的氯气在标准状况下的体积为:0.1×22.4=2.24L,答:氯气在标准状况下的体积为:2.24L;
(2)原KBr的物质的量浓度:$\frac{0.4mol}{0.2L}$=2mol/L,答:原KBr溶液的物质的量浓度为2mol/L.
点评 本题考查混合物计算,难度不大,注意利用差量法计算,根据质量守恒定律理解质量差量法.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
13.中小学生使用的涂改液被称为“隐形杀手”,是因为涂改液里主要含有二甲苯 等有机烃类物质,长期接触二甲苯会对血液循环系统产生损害,可导致再生障碍性贫血和骨髓综合症(白血病的前期).下列说法不正确的是( )
| A. | 二甲苯有三种同分异构体 | |
| B. | 二甲苯和甲苯是同系物 | |
| C. | 二甲苯分子中,所有碳原子都在同一个平面上 | |
| D. | 1mol二甲苯完全燃烧后,生成的二氧化碳和水的物质的量相等 |
14.短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且简单离子Ym-与Zn+具有相同的核外电子排布.下列化合物中同时存在非极性键和离子键的是( )
| A. | Z2Y2 | B. | X2Y2 | C. | Z2Y | D. | ZYX |
11.某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):关于该固体混合物,下列说法正确的是( )


| A. | 一定含有Al,其质量为4.5g | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
13.向含1mol NaOH、2mol NaAl(OH)4、1mol Ba(OH)2的混合液中加入稀硫酸充分反应,加入溶质H2SO4的量和生成沉淀的量的关系正确的是( )
| 选项 | A | B | C | D |
| n(H2SO4)/mol | 2 | 3 | 4 | 5 |
| n(沉淀)/mol | 2 | 3 | 2 | 1.5 |
| A. | A | B. | B | C. | C | D. | D |
 .
.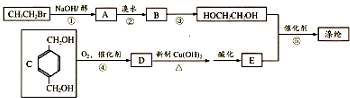
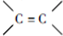 ,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液;
,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液;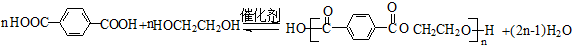 ;
;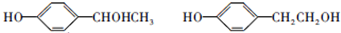 ;
;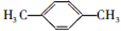 ;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.
;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.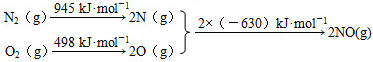 N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.


 GTN{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药.
GTN{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药.