题目内容
13.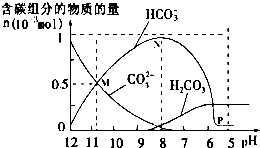 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | HCl溶液滴加一半时,溶液pH>7 | |
| B. | 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol•L-1 | |
| C. | 0.1 mol•L-1Na2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
分析 A.B、HCl溶液滴加一半时,也就是10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,其中碳酸氢钠水解溶液呈碱性;
B.n(HCO3-)=0.001mol时,溶液的pH=8,所以加入0.1mol/LHCl溶液10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠;
C.根据溶液中的电荷守恒判断;
D.在M点:n(CO32-)=n(HCO3-)=0.0005时,得到等物质的量碳酸钠和碳酸氢钠两者水解溶液呈碱;
解答 解:A.HCl溶液滴加一半时,也就是10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,其中碳酸氢钠水解溶液呈碱性,所以溶液的pH>7,故A正确;
B.n(HCO3-)=0.0001mol时,溶液的pH=8,所以加入0.1mol/LHCl溶液10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,所以溶液中NaHCO3的物质的量浓度为0.05mol/L,故B错误;
C.Na2CO3溶液中存在电荷守恒,为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故C正确;
D.在M点:n(CO32-)=n(HCO3-)=0.0005时,得到等物质的量碳酸钠和碳酸氢钠两者水解溶液呈碱,所以离子浓度大小为:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+),故D正确;
故选B.
点评 本题考查了离子浓度大小的比较,为高频考点,题目难度中等,侧重于学生的分析能力的考查,注意根据物料守恒、电荷守恒来分析解答,难点是A,注意把握图象曲线的变化特点.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
4.下列物质的制备中,不符合工业生产实际的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}}{→}$ NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{Cl_{2}}{→}$Br2$\stackrel{SO_{2}}{→}$ HBr$\stackrel{Cl_{2}}{→}$ Br2 | |
| C. | 饱和食盐水$\stackrel{电解}{→}$Cl2$\stackrel{Ca(OH)_{2}}{→}$ 漂白粉 | |
| D. | H2和Cl2混合气体$\stackrel{光照}{→}$HCl气体$\stackrel{水}{→}$ 盐酸 |
1.铋元素可表示为 83Bi,在元素周期表中相对原子质量标示为209.0,下列说法正确的是( )
| A. | Bi元素的质量数是209 | |
| B. | Bi元素最高价氧化物的化学式为Bi2O3 | |
| C. | Bi原子最高价氧化物的水化物酸性比硝酸的要强 | |
| D. | Bi元素位于元素周期表第六周期第ⅤA族 |
18.向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成.经查资料得知:Ag++2NH3•H2O?[Ag(NH3)2]++2H2O.下列分析不正确的是( )
| A. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+CI-(aq) | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 实验表明实验室可用氨水洗涤银镜反应后的试管 | |
| D. | 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl |
5.在常温时,将V1mLc1mol•L-1CH3COOH溶液中滴加到V2mLc2mol•L-1NaOH溶液中,下列结论中,错误的是( )
| A. | 如果V1=V2,c1=c2,则混合溶液中c(CH3COO-)=c(Na+) | |
| B. | 如果混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) | |
| C. | 如果混合溶液的pH>7,则不可能V1c1=V2c2 | |
| D. | 如果V1=V2,且混合溶液的pH<7,则c1>c2 |
3.物质W,Z之间有反应:4W+O2+2H2O=4Z,下列说法正确的是( )
| A. | 物质W和Z所含的元素可能相同也可能不相同 | |
| B. | 若W是一种气体,它可由氨气的催化氧化直接生成 | |
| C. | 物质W和Z所含有的某种元素,可能是地壳中或空气中含量最高的 | |
| D. | 每转移1mol电子,消耗氧气5.6L |
 N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
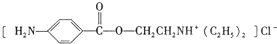 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:

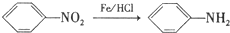

 .
.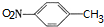 ,C中含氧官能团的名称为硝基、羧基.
,C中含氧官能团的名称为硝基、羧基. +HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$ +H2O.
+H2O. (任写一种).
(任写一种). )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 .
.