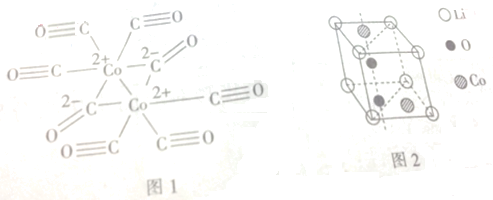
题目内容
20.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:(1)第三周期元素的原子所形成的简单离子中:还原性最弱的阴离子是Cl-;氧化性最强的阳离子是Al3+.
(2)下列事实可以作为S和Cl非金属性强弱的判断依据的是d(选填序号)
a.Cl的最高正价比S高
b.可用浓H2SO4制HCl
c.HCl的酸性比H2S强
d.Cl2与H2S反应生成S
(3)硅元素最外层有2种能量不同的电子;SiCl4的空间构型和CH4相同,写出SiCl4的电子式:
 .
.(4)PH3和NH3的某些化学性质相似.下列对晶体PH4I性质的推测,错误的是ac(选填序号)
a.PH4I是一种共价化合物
b.PH4I能与烧碱溶液反应
c.PH4I加热后会发生升华
d.PH4I溶液能与溴水反应
(5)二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似.下列有关说法不正确的是ab(选填序号)
a.S2C12分子中有4对共用电子对
b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为-1价
d.S2C12分子中各原子均为8电子稳定结构
(6)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32-②
向0.1mol/L的NaHSO3溶液中加入少量氢氧化钠固体,则$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$增大(填“增大”“减小”或“不变”,后同),$\frac{c(N{a}^{+})}{c(S{O}_{3}^{2-})}$减小.
分析 (1)元素对应单质氧化性越强,对就离子的还原性越弱;元素对应的单质还原性越弱,对应离子氧化性越强;
(2)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断;
(3)硅元素最外层有4个电子,外围电子排布3s23p2,所以有2 种能量不同的电子;SiCl4的空间构型和CH4相同,所以硅与四个氯形成四对共用电子对;
(4)a.PH4I类似NH4Cl是离子化合物;b.NH4Cl能与碱反应,所以PH4I能与烧碱溶液反应;
c.PH4I加热后会发生PH4I$\frac{\underline{\;加热\;}}{\;}$PH3↑+I2+H2↑;d.PH4I溶液中的碘离子能与溴水中的单质溴置换反应;
(5)S2C12的分子结构与H2O2相似,所以S2C12的分子结构与H2O2相似,所以分子中有4对共用电子对,S2C12分子中有硫硫非极性,S2C12分子中,S为+1价,Cl为-1,S2C12分子中各原子均为8电子稳定结构.
(6)已知NaHSO3溶液显酸性,说明电离大于水解,加入氢氧化钠,平衡HSO3-?H++SO32-正向移动,由此分析解答.
解答 解:(1)元素对应单质氧化性越强,对就离子的还原性越弱,所以最弱的是氯离子;元素对应的单质还原性越弱,对应离子氧化性越强,所以最强的是铝离子,故答案为:氯离子;铝离子;
(2)a.Cl的最高正价比S高,不能通过化合价来判断非金属性强弱,故错误;
b.可用浓H2SO4制HCl,是不挥发制挥发的,故错误;
c.HCl的酸性比H2S强,不是最高价含氧酸的酸性,故错误;
d.Cl2与H2S反应生成S,氯的非金属性强于硫,故正确;
故选d;
(3)硅元素最外层有4个电子,外围电子排布3s23p2,所以有2 种能量不同的电子;SiCl4的空间构型和CH4相同,所以硅与四个氯形成四对共用电子对,电子式为: ,故答案为:2;
,故答案为:2; ;
;
(4)a.PH4I类似NH4Cl是离子化合物,故错误;
b.NH4Cl能与碱反应,所以PH4I能与烧碱溶液反应,故正确;
c.PH4I加热后会发生PH4I$\frac{\underline{\;加热\;}}{\;}$PH3↑+I2+H2↑,发生分解而不是升华,故错误;
d.PH4I溶液中的碘离子能与溴水中的单质溴置换反应,故正确;
故选ac;
(5)S2C12的分子结构与H2O2相似,所以S2C12的分子结构与H2O2相似,结构式为Cl-S-S-Cl,所以分子中有3对共用电子对,S2C12分子中有硫硫非极性,S2C12分子中,S为+1价,Cl为-1,S2C12分子中各原子均为8电子稳定结构,故选ab.
(6)已知NaHSO3溶液显酸性,说明电离大于水解,加入氢氧化钠,平衡HSO3-?H++SO32-正向移动,所以亚硫酸根离子的浓度变大,亚硫酸氢根离子的浓度减小,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$的比值增大,
加入少量的氢氧化钠,假设加入的NaOH刚好使NaHSO3转化为Na2SO3,此时溶液中$\frac{c(N{a}^{+})}{c(S{O}_{3}^{2-})}$约是2:1,没有加入NaOH时,NaHSO3溶液中HSO3-水解程度很小,则SO32-离子很小(HSO3-水解程度远远小于50%),溶液中$\frac{c(N{a}^{+})}{c(S{O}_{3}^{2-})}$远远大于2:1,故加入少量NaOH时液中$\frac{c(N{a}^{+})}{c(S{O}_{3}^{2-})}$减小,故答案为:增大;减小.
点评 本题考查元素周期律、元素化合物的性质和化学平衡的移动的相关知识,学生只要掌握元素周期律的知识和平衡移动的原理就能迅速解题,比较容易.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 地沟油的主要成分是油脂,其组成与汽油、煤油相同 | |
| C. | 合成纤维、人造纤维及光导纤维都属于有机高分子材料 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |

| A. | 一定含有Al,其质量为4.5g | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
| A. | 如果V1=V2,c1=c2,则混合溶液中c(CH3COO-)=c(Na+) | |
| B. | 如果混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) | |
| C. | 如果混合溶液的pH>7,则不可能V1c1=V2c2 | |
| D. | 如果V1=V2,且混合溶液的pH<7,则c1>c2 |
| A. | H2SO4 | B. | HCl | C. | HClO | D. | Ba(HSO3)2 |
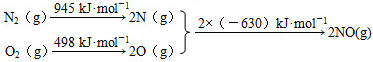 N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.


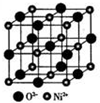 GTN{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药.
GTN{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药.