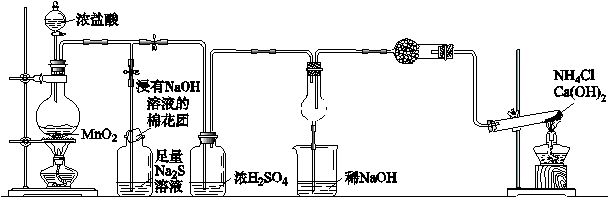
题目内容
下图是研究铜与浓硫酸的反应装置:

(1)A试管中发生反应的化学方程式为 。
(2)反应一段时间后,可观察到B试管中的现象为 。
(3)C试管口浸有NaOH溶液的棉团作用是 。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是 、 。(要求填一种化合物和一种单质的化学式;如有需要,可加装防倒吸装置。)
(5)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是 。
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
仅由
| 资料1 |  附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
上述资料可得出的正确结论是 。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)溶液由红色变成无色
(3)吸收Cl2和SO2,防止污染空气
(4)NH3(NO2 或ClO2); Cl2(O3 或 O2 或Br2蒸汽)
(5)向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色。
(6)a b d
解析试题分析:(1)铜与浓硫酸在加热条件下发生发生反应;(2)生成的二氧化硫通入到品红溶液中,使品红溶液褪色;(3)饱和氯水中有挥发出的氯气,C中有通入的二氧化硫,故氢氧化钠吸收氯气和二氧化硫;(4)二氧化硫和氯化钡不反应,通入氨气,在碱性条件下把二氧化硫转化成亚硫酸根离子,和钡离子生成亚硫酸钡沉淀,通入氯气,把二氧化硫氧化成硫酸根离子,和钡离子生成硫酸钡沉淀,故提供碱性环境或强氧化环境即可有沉淀生成;(5)检验铜离子可通过观察溶液的颜色来判断;(6)根据铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种可以判断a正确;根据硫酸浓度为15mol/L和16mol/L时最后黑色物质都消失了,故b正确;通过信息只看出大于15mol/L时发生反应了,不能说明小于15mol/L时不反应,故c错误;根据资料1中的对比可得D正确。
考点:考查铜与浓硫酸的反应、二氧化硫的化学性质、根据题目信息分析解决问题的能力等。

某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。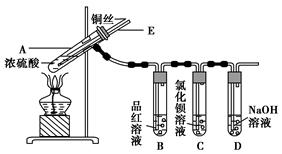
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为 。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是 。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | | |
写出其中SO2表现还原性的离子反应方程式: 。
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是 。
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是 。
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体 mol(不考虑溶解的SO2)。
某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取.
①碳酸钠 ②碳酸氢钠 ③碳酸氢铵 ④氯化铵 ⑤熟石灰 ⑥氢氧化钠
按上图连接好各仪器,现将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解,回答下列问题:
(1)若A中制取气体时只用了一种药品,则该药品是 (填物质序号)
(2)B装置的作用为
(3)D中铜片发生反应的离子方程式为 ,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的 (填下列各项序号)
| A.Na2CO3 | B.AgNO3 | C.H2SO4 | D.FeSO4 |
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见: 。
Na2S2O3·5H2O(俗称海波或大苏打)是照相业常用的一种定影剂。
(一)常用下列途径制备海波:
已知反应:4FeS+7O2  2Fe2O3+4SO2、Na2SO3+S
2Fe2O3+4SO2、Na2SO3+S Na2S2O3
Na2S2O3
(1)计算原料FeS在反应(a)和(b)中的理论分配比:_________。
(2)现有88gFeS,设NaOH溶液吸收SO2的吸收率为96%,问最多制备海波质量为____克(精确到0.1克)
(二)工业上制得的海波晶体中可能含有少量的亚硫酸钠和硫酸钠杂质。为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后过滤出硫,微热滤液使生成的SO2全部逸出(Na2S2O3+ H2SO4® Na2SO4+ SO2↑+ S↓+ H2O)。测得有关实验数据如下(标准状况):
| | 第一份 | 第二份 | 第三份 |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.80 | 1.60 | 3.20 |
(3)计算所用硫酸溶液的物质的量浓度。(写出计算过程)
(4)分析以上实验数据,可判断该样品__________(填字母)
A.不含Na2SO3和Na2SO4 B.不含Na2SO3 含Na2SO4
C.含Na2SO3不含Na2SO4 D.含Na2SO3和Na2SO4
(5)若将30.16g该样品和一定量的上述硫酸溶液混合微热。试讨论:当加入硫酸的体积______(aL)在不同取值范围时,生成SO2体积___________(bL,标态)的值。(可用含a和b的代数式表示)
某化学研究性学习小组对硫酸铜分解气体产物的成分进行如下探究:
【查阅资料】
硫酸铜受热分解生成氧化铜和气体,温度不同时,气体可能为SO3,SO2和O2中的一种、两种或三种。
【提出假设】
假设1:气体产物只有一种;
假设2:气体产物只有两种;
假设3:气体产物有三种。
(1)若假设1成立,则产物气体的成分是 ;若假设2成立,则产物气体的成分是 。
【实验及结果讨论】
(2)甲同学将分解生成的气体依次通过盛浓硫酸和KMnO4酸性溶液的洗气瓶,能说明产物气体中含SO2的现象是 ,该现象说明SO2具有的性质是 ,实验中还发现盛浓硫酸的洗气瓶质量明显增加,原因是 。
(3)乙同学将分解生成的气体通过碱石灰后,再收集测定剩余气体的体积,在不同温度下进行3组实验。请完成下表(实验中硫酸铜均完全分解):
| 实验 序号 | 称取CuSO4 的质量/g | 碱石灰的 增加质量/g | 剩余气体的体积(折算 成标准状况下)/mL | 结论 |
| Ⅰ | 6.4 | | | 假设1成立 |
| Ⅱ | 6.4 | 2.88 | 224 | |
| Ⅲ | 6.4 | 2.56 | 448 | |

 R-CH(OH)SO3Na
R-CH(OH)SO3Na