题目内容
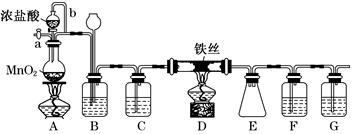
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)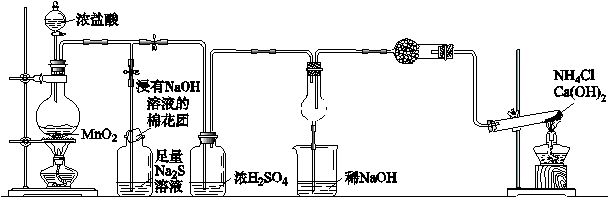
A B C D E
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫的原因 。
(4)D中干燥管中出现的现象及化学方程式 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图 (并注明盛装试剂)。
(6)还有什么方法能证明氧化性Cl2 > S,用一种相关事实说明 。
(1)MnO2 + 4H+ + 2Cl- Mn2+ + Cl2 ↑+ 2H2O (2分)
Mn2+ + Cl2 ↑+ 2H2O (2分)
(2)S2- + Cl2 =" S↓" + 2Cl- (2分)
(3)氯的原子半径小于硫,得电子能力强于硫,所以氧化性Cl2强于S (2分)
(4)产生大量白烟,8NH3 + 3Cl2 = 6NH4Cl + N2 (3分)
(5)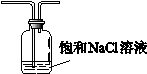 (2分)
(2分)
(6)2Fe + 3Cl2 2FeCl3、Fe+S
2FeCl3、Fe+S FeS(其它合理答案给分) (2分)
FeS(其它合理答案给分) (2分)
解析试题分析:(1)A为实验室制氯气的反应,其离子方程式为MnO2 + 4H+ + 2Cl- Mn2+ + Cl2 ↑+ 2H2O
Mn2+ + Cl2 ↑+ 2H2O
(2)B中出现黄色浑浊现象,是因为氯气将S2-氧化成S单质,对应的离子方程式为S2- + Cl2 =" S↓" + 2Cl-
(3)从原子结构角度,氯的原子半径小比硫小,核对最外层电子的吸引能力比硫强,所以得电子能力强,因此氧化性Cl2强于S
(4)E装置中产生氨气,具有氧化性的氯气与具有还原性的氨气发生氧化还原反应生成白色的氯化铵,所以D中出现的现象是有白烟生成,反应的化学方程式是8NH3+3Cl2=6NH4Cl+N2
(5)由A产生的氯气中含有HCl未经除杂进入D中,所以D产生的白烟现象可能是HCl与NH3结合所致,需在D前加除杂装置,常用饱和食盐水吸收HCl,装置如图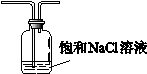
(6)证明氧化性Cl2 > S还可以用二者都可以和铁单质反应,但产物中铁元素的价态不同来说明。对应的方程式为2Fe + 3Cl2 2FeCl3、Fe+S
2FeCl3、Fe+S FeS
FeS
考点:考查制取氯气的离子方程式的书写及氯气的化学性质,原子结构与性质的关系,对实验现象的分析判断,氧化性强弱的判断,实验设计

(15分)
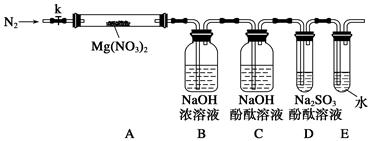
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。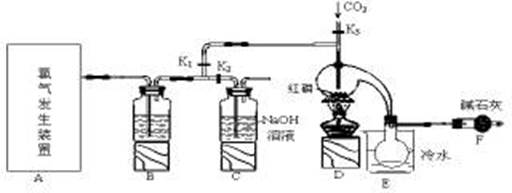
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)写出A中反应的离子方程式 。
(2)B装置中所盛试剂是 ;E中烧杯内冷水的作用是 。
(3)实验前玻璃管之间连接需要用到橡皮管,其连接方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管中。
(4)检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。其中通入干燥CO2的目的是 。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过 (填实验名称)即可得到较纯净的PCl3。
(6)实验后关闭K1,打开K2,将A、B中余氯通入300ml 1mol/L的NaOH溶液中。若NaOH恰好完全反应,则吸收氯气的物质的量为(假设反应生成了NaCl 、 NaClO 和 NaClO3等钠盐) mol,反应中转移电子的物质的量(n)的范围是 。
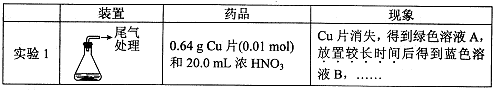
下图是研究铜与浓硫酸的反应装置:

(1)A试管中发生反应的化学方程式为 。
(2)反应一段时间后,可观察到B试管中的现象为 。
(3)C试管口浸有NaOH溶液的棉团作用是 。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是 、 。(要求填一种化合物和一种单质的化学式;如有需要,可加装防倒吸装置。)
(5)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是 。
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
仅由
| 资料1 |  附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
上述资料可得出的正确结论是 。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L
d.硫酸浓度越大,黑色物质越快出现、越难消失
某课外兴趣小组为探究铜跟浓硫酸反应情况,用下图所示装置进行实验。已知:①SO2难溶于饱和亚硫酸氢钠溶液;②SO2能与酸性高锰酸钾溶液发生氧化还原反应使之褪色(化学方程式为5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4)。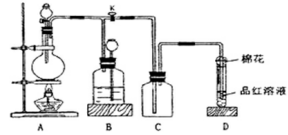
回答下列问题(注:E为止水夹,F为旋塞):
(1)检查A装置的气密性的方法 。
(2)装置A中反应的化学方程式为 。
(3)装置D中试管口放置的棉花应蘸有NaOH溶液,
其作用是 。
(4)装置B具有贮存气体的作用。当D处有明显的现象后,关闭旋塞F并移去酒精灯,由于余热的作用,A处仍有气体产生,此时B中的现象是 ,B中应放置的液体是(填字母) 。
| A.水 | B.饱和NaHSO3溶液 | C.酸性KMnO4溶液 | D.NaOH溶液 |
 Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)

 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O