��Ŀ����
Na2S2O3��5H2O���׳ƺ�������մ�������ҵ���õ�һ�ֶ�Ӱ����
��һ)��������;���Ʊ�������
��֪��Ӧ��4FeS+7O2  2Fe2O3+4SO2��Na2SO3+S
2Fe2O3+4SO2��Na2SO3+S Na2S2O3
Na2S2O3
��1������ԭ��FeS�ڷ�Ӧ(a)��(b)�е����۷���ȣ�_________��
��2������88gFeS����NaOH��Һ����SO2��������Ϊ96%��������Ʊ���������Ϊ____�ˣ���ȷ��0��1�ˣ�
��������ҵ���Ƶõĺ��������п��ܺ����������������ƺ����������ʡ�Ϊ�˲ⶨij������Ʒ�ijɷ֣���ȡ����������ͬ�ĸ���Ʒ���ֱ������ͬŨ�ȵ�������Һ30mL����ַ�Ӧ����˳�������Һʹ���ɵ�SO2ȫ���ݳ���Na2S2O3+ H2SO4® Na2SO4+ SO2��+ S��+ H2O��������й�ʵ���������£���״������
| | ��һ�� | �ڶ��� | ������ |
| ��Ʒ������/g | 7��54 | 15��08 | 35��00 |
| ������������/L | 0��672 | 1��344 | 2��688 |
| �������/g | 0��80 | 1��60 | 3��20 |
��3����������������Һ�����ʵ���Ũ�ȡ�(д���������)
��4����������ʵ�����ݣ����жϸ���Ʒ__________������ĸ��
A������Na2SO3��Na2SO4 B������Na2SO3 ��Na2SO4
C����Na2SO3����Na2SO4 D����Na2SO3��Na2SO4
��5������30��16g����Ʒ��һ����������������Һ����ȡ������ۣ���������������______(aL)�ڲ�ͬȡֵ��Χʱ������SO2���___________(bL,��̬)��ֵ�������ú�a��b�Ĵ���ʽ��ʾ��
��1��2:1
��2��121��5 g
��3��4mol/L
��4��D
��5��0<a<0��03Lʱ b=89��6a �� a��0��03Lʱ b=2��688
�������������
��1��4FeS+7O2 2Fe2O3+4SO2, FeS+2HCl=FeCl2+H2S����2H2S +SO2=3S+2H2O��SO2+2NaOH=Na2SO3+ H2O��Na2SO3+S
2Fe2O3+4SO2, FeS+2HCl=FeCl2+H2S����2H2S +SO2=3S+2H2O��SO2+2NaOH=Na2SO3+ H2O��Na2SO3+S Na2S2O3����ǡ����ȫ��Ӧ����Na2SO3��S=1:1�����ݷ���ʽ�������ƣ��ɵõ�FeS�ڷ�Ӧ(a)��(b)�е����۷����Ϊ2:1��
Na2S2O3����ǡ����ȫ��Ӧ����Na2SO3��S=1:1�����ݷ���ʽ�������ƣ��ɵõ�FeS�ڷ�Ӧ(a)��(b)�е����۷����Ϊ2:1��
��2��(1)n(FeS)=88g��88g/mol=1mol�����Ʊ�����������ࡣ����ݷ���ʽNa2SO3+S Na2S2O3��֪Na2SO3��S=1:1�����������Na2SO3�����ʵ���Ϊx������NaOH��Һ����SO2��������Ϊ96%����Ӧ���ĵ�SO2�����ʵ���Ϊx��0��96�������S��ȫ(1- x��0��96)��ȫת��ΪS���ʣ� 1- x��0��96=x�����x=0��4898�����Եõ���Na2S2O3��5H2O����Ϊ��0��4898mol��248g/mol=121��5 g��
Na2S2O3��֪Na2SO3��S=1:1�����������Na2SO3�����ʵ���Ϊx������NaOH��Һ����SO2��������Ϊ96%����Ӧ���ĵ�SO2�����ʵ���Ϊx��0��96�������S��ȫ(1- x��0��96)��ȫת��ΪS���ʣ� 1- x��0��96=x�����x=0��4898�����Եõ���Na2S2O3��5H2O����Ϊ��0��4898mol��248g/mol=121��5 g��
��3��ͨ���Ա��е����ݽ��з������ֵ���������������ȫ��Ӧ���йصķ�Ӧ����ʽΪNa2S2O3+ H2SO4= Na2SO4+ SO2��+ S��+ H2O��Na2SO3+ H2SO4= Na2SO4+ SO2��+H2O���ɼ��������ᷢ���Ǹ���Ӧ���й�ϵʽH2SO4��SO2��n(SO2)= 2��688L��22��4L/mol=0��12mol������n(H2SO4)= 0��12mol��c(H2SO4) =0��12mol��0��03L=4mol/L��
��4��n(S)=0��1mol,����ݷ���ʽNa2S2O3+ H2SO4= Na2SO4+ SO2��+ S��+ H2O��֪n(Na2S2O3)=0��1mol, m(Na2S2O3��5H2O)=24��8g;��������SO2Ҳ��0��1mol����Na2SO3������SO2Ϊ0��12mol-0��1mol=0��02mol������n(Na2SO3)=0��02mol��m(Na2SO3)=0��02mol��126g/mol=2��52g������m(Na2S2O3��5H2O)��m(Na2SO3) = 24��8g��2��52g=27��32g<35��00g�������ڸù����л�����Na2SO4�����ѡ��ΪD��
��5��ͨ�����������е����ݷ�����֪30ml������ǡ������Ʒ��ȫ��Ӧʱ���������Ϊ30��16g �������0<a<0��03ʱ������������ų�����������������������㡣b=��2��688L��0��03����a=89��6a ���� a��0��03Lʱ�������������Ʒ��ȫ��Ӧ����������������b=2��688L��
���㣺���麣����Na2S2O3��5H2O����ȡ�����������ȵļ����֪ʶ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д���1��ij��ȤС����ʵ����̽����ҵ�ϳ�����Ļ�ѧԭ����
�ٰ��Ĵ�������ͼa��̽�����Ĵ������ļ���װ�ã�ʵ���й۲쵽��ƿ�в�˿���ֺ��ȣ��к���ɫ�������ɻ���̲��������̵ijɷ��� ���ѧʽ����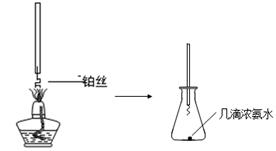
ͼa ͼb
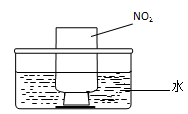
��NO2�����գ���ͼb��ʾ����һƿNO2������ˮ���У���ˮ���ƿ�����Ƭ���ɹ۲쵽�������� ��
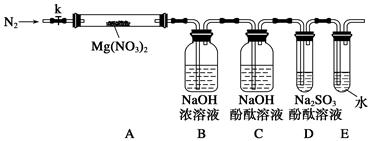
��2������������Һ��Fe3+ˮ������ػ�ɫ������Fe(NO3)3��ҺΪ�������ʵ��̽��Ӱ������ˮ��̶ȵ����ء�
��д��Fe(NO3)3ˮ������ӷ���ʽ ��
�ڲ���ʾ������±�ʵ�鷽������ơ�
��ѡ���ϣ�0.05mol?L-1Fe(NO3)3��0.5mol?L-1Fe(NO3)3��1.0mol?L-1HNO3��1.0mol?L-1NaOH��NaHCO3���塢����ˮ����ˮ����pH�Ƽ���������������
| ����Ӱ������ | ʵ����� | Ԥ������ͽ��� |
| ��Һ������� | ȡ����0.5mol?L-1Fe(NO3)3���Թ��У����뼸��1mol?L-1HNO3�� | �ػ�ɫ��Һ��ɫ��dz��˵����Һ������ǿ������Fe(NO3)3��ˮ�⡣ |
| �ε�Ũ�� | | |
| | | |
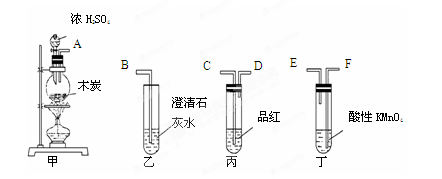
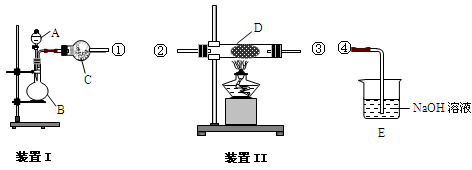
��ͼ���о�ͭ��Ũ����ķ�Ӧװ�ã�

��1��A�Թ��з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧһ��ʱ��ɹ۲쵽B�Թ��е�����Ϊ ��
��3��C�Թܿڽ���NaOH��Һ������������ ��
��4���罫B�Թܻ���D�Թܣ�����ֱ����������BaCl2��Һ��ͨ����һ�����壬������ɫ����������������� �� ����Ҫ����һ�ֻ������һ�ֵ��ʵĻ�ѧʽ��������Ҫ���ɼ�װ������װ�á���
��5��ʵ�������֤��A�Թ��з�Ӧ���ò����Ƿ���ͭ���ӵIJ��������� ��
��6����ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣�������������������ϡ�
����
| ����1 |  ����ͭ��Ũ���ᷴӦ������ɫ���ʵ�������� |
| ����2 | X���߾������������ͭ��Ũ���ᷴӦ���ɵĺ�ɫ����ΪCu2S��CuS��Cu7S4�е�һ�ֻ��֡� |
�������Ͽɵó�����ȷ������ ��
a��ͭ��Ũ���ᷴӦʱ���漰�ķ�Ӧ���ܲ�ֹһ��
b������Ũ��ѡ���ʵ����ɱ����������г��ֺ�ɫ����
c���÷�Ӧ����������֮һ������Ũ�ȡ�15 mol��L
d������Ũ��Խ��ɫ����Խ����֡�Խ����ʧ
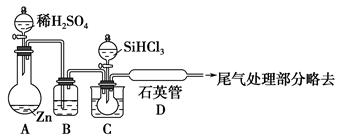
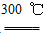 SiHCl3��H2
SiHCl3��H2