题目内容
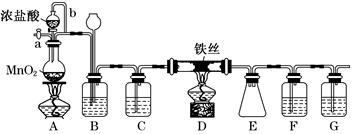
单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式 。
(2)装置C中的试剂是 ;装置F的作用是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式: 。
②滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
③滴定前检验Fe3+是否被完全还原的实验操作是 。
(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(2)浓硫酸(2分);
防止空气中的水进入H中;产物SiCl4沸点低,需要冷凝收集(2分)
(3)①5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
②否;KMnO4溶液的紫红色可指示反应终点;(2分)
③取少量还原后的溶液于试管中,滴加KSCN溶液,若不出现血红色,表明Fe3+已完全还原(2分)
解析试题分析:(1)装置A为制取氯气的装置,所以发生的离子反应方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)装置B为除去氯气中的氯化氢,所以装置C中的试剂是浓硫酸,干燥氯气;四氯化硅遇水易水解,所以装置F的作用是防止空气中的水进入H中;产物SiCl4沸点低,需要冷凝收集,所以h瓶需要冷却;
(3)①亚铁离子与酸性高锰酸钾反应被氧化成铁离子,高锰酸钾被还原成锰离子,离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②滴定前不用加任何指示剂,因为高锰酸钾溶液本身为紫红色溶液,可用高锰酸钾溶液的颜色判断反应终点;
③Fe3+的检验通常用KSCN溶液,取少量还原后的溶液于试管中,滴加KSCN溶液,若不出现血红色,表明Fe3+已完全还原。
考点:考查氯气的制取化学方程式,装置作用的判断,离子方程式的书写,亚铁离子的检验

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案(15分)
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。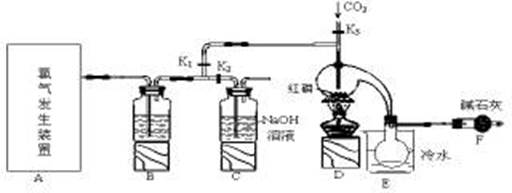
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)写出A中反应的离子方程式 。
(2)B装置中所盛试剂是 ;E中烧杯内冷水的作用是 。
(3)实验前玻璃管之间连接需要用到橡皮管,其连接方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管中。
(4)检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。其中通入干燥CO2的目的是 。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过 (填实验名称)即可得到较纯净的PCl3。
(6)实验后关闭K1,打开K2,将A、B中余氯通入300ml 1mol/L的NaOH溶液中。若NaOH恰好完全反应,则吸收氯气的物质的量为(假设反应生成了NaCl 、 NaClO 和 NaClO3等钠盐) mol,反应中转移电子的物质的量(n)的范围是 。
已知:ICl的熔点为13.90C,沸点为97.40C,易水解,且能发生反应:ICl(l)+ Cl2(g)=ICl3(l)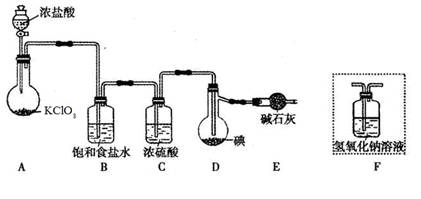
(1)装置A中发生反应的化学方程式是____________ 。
(2)装置B的作用是______。不能用装置F代替装置E,理由____________ 。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |
①

②ICl+KI=I2+KCl
③I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将5.00g该油脂样品溶于四氯化碳后形成100mL溶液,从中取出十分之一,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol.L-1的Na2S2O3标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL。
①滴定过程中可用______ 作指示剂。
②滴定过程中需要不断振荡,否则会导致V1______(填“偏大”或“偏小)。
③5.00g该油脂样品所消耗的ICl的物质的量为__mol。由此数据经换算即可求得该油脂的不饱和度。
(1)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。白烟的成分是 (填化学式)。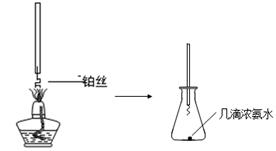
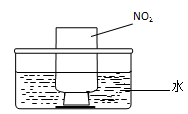
图a 图b
②NO2的吸收:如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是 。
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素。
①写出Fe(NO3)3水解的离子方程式 。
②参照示例完成下表实验方案的设计。
限选材料:0.05mol?L-1Fe(NO3)3、0.5mol?L-1Fe(NO3)3、1.0mol?L-1HNO3、1.0mol?L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;pH计及其他常见仪器。
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| 溶液的酸碱性 | 取少量0.5mol?L-1Fe(NO3)3于试管中,加入几滴1mol?L-1HNO3。 | 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。 |
| 盐的浓度 | | |
| | | |
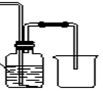
下图是研究铜与浓硫酸的反应装置:

(1)A试管中发生反应的化学方程式为 。
(2)反应一段时间后,可观察到B试管中的现象为 。
(3)C试管口浸有NaOH溶液的棉团作用是 。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是 、 。(要求填一种化合物和一种单质的化学式;如有需要,可加装防倒吸装置。)
(5)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是 。
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
仅由
| 资料1 |  附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
上述资料可得出的正确结论是 。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L
d.硫酸浓度越大,黑色物质越快出现、越难消失
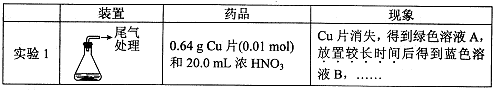
 Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)