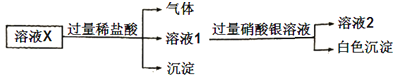
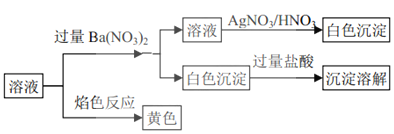
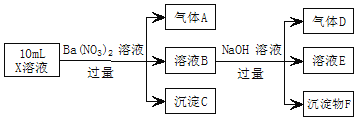
题目内容
【题目】高铁酸钾纯品为暗紫色有光泽粉末。在198 ![]() 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为![]() (未配平),下列有关说法不正确的是( )
(未配平),下列有关说法不正确的是( )
A.由上述反应可知,Fe(OH)3的氧化性强于![]()
B.高铁酸钾中铁显 + 6价
C.上述反应氧化剂和还原剂的物质的量之比为3 : 2
D.K2FeO4处理水时,不仅能消毒杀菌,而且生成Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
【答案】A
【解析】
A.根据题干信息,工业制备高铁酸钾的离子方程式为![]() ,反应中Fe(OH)3中Fe的化合价升高,失去电子发生氧化反应,则Fe(OH)3作还原剂,
,反应中Fe(OH)3中Fe的化合价升高,失去电子发生氧化反应,则Fe(OH)3作还原剂,![]() 为氧化产物,因此还原性:Fe(OH)3>
为氧化产物,因此还原性:Fe(OH)3>![]() ,则氧化性:Fe(OH)3<
,则氧化性:Fe(OH)3<![]() ,A选项错误;
,A选项错误;
B.K2FeO4中K元素为+1价,O元素为-2价,根据化合物化合价为0可知,Fe的化合价为+6价,B选项正确;
C.反应![]() 中氧化剂为ClO-,还原剂为Fe(OH)3,氧化剂和还原剂的物质的量之比为3:2,C选项正确;
中氧化剂为ClO-,还原剂为Fe(OH)3,氧化剂和还原剂的物质的量之比为3:2,C选项正确;
D.K2FeO4具有强氧化性,在处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质,D选项正确;
答案选A.

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】已知硫代硫酸钠在酸性条件下会发生反应:![]() ,下表中的两种溶液混合,出现浑浊的先后顺序是( )
,下表中的两种溶液混合,出现浑浊的先后顺序是( )
组号 | 两种溶液的温度 |
| 稀硫酸的体积、浓度 |
① | 15℃ | 10mL0.1mol/L | 50mL0.05mol/L |
② | 15℃ | 10mL0.05mol/L | 10mL0.1mol/L |
③ | 25℃ | 10mL0.05mol/L | 10mL0.1mol/L |
④ | 25℃ | 10mL0.1mol/L | 30mL0.07mol/L |
A.④①②③B.③④②①
C.④③②①D.④③①②