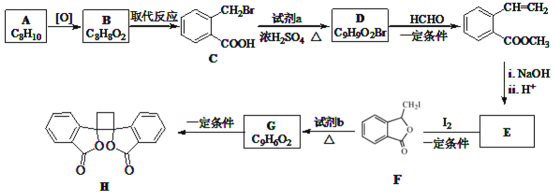
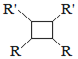
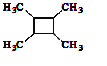
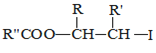题目内容
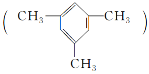
【题目】某固体混合物中可能含有:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子,将该固体溶解所得到的溶液进行如下实验:下列说法正确的是
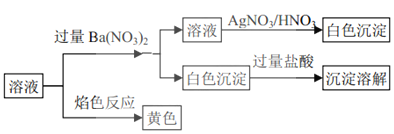
等离子,将该固体溶解所得到的溶液进行如下实验:下列说法正确的是![]()
A.该混合物一定是![]() 和NaCl
和NaCl
B.该混合物可能是![]() 和KCl
和KCl
C.该混合物一定是![]() 和NaCl
和NaCl
D.该混合物可能是![]() 和
和![]()
【答案】B
【解析】
焰色反应显黄色,说明一定存在钠离子,可能有钾离子。加入过量的硝酸钡溶液产生白色沉淀,白色沉淀完全溶解在盐酸中,说明一定存在碳酸根,不存在硫酸根。滤液中加入硝酸酸化的硝酸银得到白色沉淀,说明含有氯离子,即一定存在Na+、Cl-、CO32-,一定不存在SO42-,可能含有K+,据此分析。
由上述分析可知,一定含![]() 、
、![]() 、
、![]() ,不含
,不含![]() ,不能确定是否含
,不能确定是否含![]() ,
,
A.该混合物可能是![]() 和NaCl,因不能确定是否含
和NaCl,因不能确定是否含![]() ,选项A不选;
,选项A不选;
B.由分析出的离子可知该混合物可能是![]() 和KCl,选项B选;
和KCl,选项B选;
C.不能确定是否含![]() ,可能为
,可能为![]() 和NaCl,选项C不选;
和NaCl,选项C不选;
D.不含![]() ,则不可能含
,则不可能含![]() ,选项D不选;
,选项D不选;
答案选B。

【题目】某学生用0.2000mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A、量取20.0ml待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
B、用标准溶液润洗滴定管2-3次;
C、取盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D、取标准NaOH溶液注入碱式滴定管至刻度线0以上2cm-3cm;
E、调节液面至“0”或“0”以下刻度并记下读数;
F、把锥形瓶放在滴定管的下面,用NaOH溶液滴定至终点并记下滴定管液面的刻度
据此实验完成填空:
(1)正确操作步骤的顺序是___。(用序号字母填写)
(2)用标准的NaOH溶液滴定待测盐酸时,左手握碱式滴定管的带有玻璃球的橡胶管部分,右手摇动锥形瓶,眼睛注视___。判断滴定终点的方法是___。
(3)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测液 体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 21.99 |
3 | 20.00 | 1.20 | 23.20 |
①根据上述数据,可计算出该盐酸的浓度为___(保留两位有效数字).
②在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___(填字母序号)
A.滴定终点读数时俯视读数
B.碱式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失