��Ŀ����
����Ŀ��̼��Ԫ�صĵ��ʼ��仯��������������������һ����Ҫ���ʡ���ش���������
(1)̼ԭ�Ӻ�����__�ֲ�ͬ�˶�״̬�ĵ��ӣ���һ�����ܽ������̼֮���Ԫ�ص�����Ϊ__��̼��Ԫ����Χ�����Ų���ͨʽΪ__��
(2)�����أ�C15H22O5���Ľṹ��ͼ��ʾ��ͼ�����ֱ�ʶ�����̼ԭ�ӵ��ӻ��������Ϊ__����������ص�����Ԫ�ص縺���ɴ�С������__��

(3)�����ط����У���Ԫ�صijɼ���ʽ��___������������ȡ�����ص�����ܼ���___��
a���Ҵ� b������ c��ˮ
(4)SnO2��һ����Ҫ�İ뵼�崫�������ϣ������Ʊ������ȸߵ�������������SnO2������NaOH��Ӧ����Na2SnO3��Na2SnO3�������ӿռ乹��Ϊ__��
(5)������̫���ܵ�������л�����±����⻯Ǧ�װ�(CH3NH3PbI3����Է�������ΪMr)�뵼����Ϊ������ϣ�CH3NH3PbI3���и��ѿ�(AMX3)�������ṹ���侧����ͼ��ʾ��AMX3�����������������(M)���������±��������(X)�γ���������ṹ����X����__λ�á�CH3NH3PbI3����ľ�������Ϊanm���侧���ܶ�Ϊdg��cm-3�����ӵ�������ֵNA�ļ������ʽΪ__��

���𰸡�6 �� ns2np2 sp2��sp3 O>C>H ���������� b ƽ�������� ���� ![]()
��������
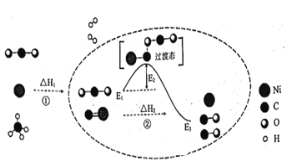
��ԭ�ӵĺ�������У�û���˶�״̬��ȫ��ͬ���������Ӵ��ڣ�����ԭ�Ӻ����ж��ٸ����ӣ����ж������˶�״̬��һ����˵��Ԫ�صķǽ�����Խǿ��Ԫ�صĵ縺�Դ��ܵ���˵��һ������Խ����ԭ�Ӻ���۵��Ӵ��ڰ�����ȫ��״̬ʱ�������ͣ���һ�����ܷ�����������ԭ������������1��Ԫ�ش�ԭ�Ӻ�������ӻ��Ĺ��Ϊ�γ������������ڵĹ���¶Ե������ڵĹ�����л���ͨ�������������ṹ���Ƶ��л���ж����Ľṹʱ���迴����ԭ�ӵļ۲���Ӷ������µ��Ӷ�������AMX3�ľ����У������������Ϊ8��![]() =1����������ĸ���Ϊ6��
=1����������ĸ���Ϊ6��![]() =3�����ߵĸ�����Ϊ1:3�����ջ�ѧʽ����ȷ������ΪM���ӣ�����ΪX���ӣ�����λ�ڸ���������ġ�
=3�����ߵĸ�����Ϊ1:3�����ջ�ѧʽ����ȷ������ΪM���ӣ�����ΪX���ӣ�����λ�ڸ���������ġ�
(1)̼Ϊ6��Ԫ�أ�ԭ�Ӻ�����6�����ӣ���6�ֲ�ͬ�˶�״̬�ĵ��ӣ����2s�ܼ�����2�����ӣ�����ȫ��״̬����һ�����ܱ�������Ե�һ�����ܽ������̼֮���Ԫ�ص�����Ϊ�룬̼ԭ�ӵ���Χ�����Ų�Ϊ2s22p2������̼��Ԫ����Χ�����Ų���ͨʽΪns2np2����Ϊ��6���룻ns2np2��
(2)ͼ�����ֱ�ʶ�����̼ԭ���У�ֻ��3��̼ԭ�ӵļ۵��Ӷ���Ϊ3������̼ԭ�ӵļ۲���Ӷ�����Ϊ4�������ӻ��������Ϊsp2��sp3����������ص�����Ԫ�طֱ�ΪC��H��O���ǽ�����O>C>H�����Ե縺���ɴ�С������O>C>H����Ϊ��sp2��sp3��O>C>H��
(3)�����ط����У�4��Oԭ���γɵ�����1��Oԭ���γ�˫����������Ԫ�صijɼ���ʽ�������������������ط����к���2���Ѽ������������࣬���Դ���������ȡ�����ص�����ܼ������ѣ���ѡb����Ϊ��������������b��
(4)��Na2SnO3�У������ӵļ۵��Ӷ���Ϊ3�������ڹµ��Ӷԣ�������ռ乹��Ϊƽ�������Ρ���Ϊ��ƽ�������Σ�
(5)�ӷ�����֪��ͼ��AMX3�����к���Ϊ����������(M)������Ϊ±��������(X)���γ���������ṹ����X��������λ�á��Ӿ����ṹ����1�������У�ֻ����1����AMX3������CH3NH3PbI3�ľ�����Ҳֻ����1����CH3NH3PbI3����CH3NH3PbI3����ľ�������Ϊanm���侧���ܶ�Ϊdg��cm-3����dg��cm-3=![]() �������ӵ�������ֵNA�ļ������ʽΪNA=
�������ӵ�������ֵNA�ļ������ʽΪNA=![]() ����Ϊ�����ģ�
����Ϊ�����ģ�![]() ��
��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��ij���Թ�ҵ��ˮ�к���K2Cr2O7�������£����ᣨH2C2O4���ܽ����е�Cr2O72-ת��ΪCr3+��ij�������о����֣�����������[Al2Fe(SO4)4��24H2O]���ɶԸ÷�Ӧ��������á�Ϊ��һ���о��й����ضԸ÷�Ӧ���ʵ�Ӱ�죬̽�����£�
��1����25��C�£����ƹ���ǿ�ȡ���ˮ��Ʒ��ʼŨ�Ⱥʹ���������ͬ�����ڲ�ͬ�ij�ʼpH��һ��Ũ�Ȳ�����Һ���������Ա�ʵ�顣���������ʵ����Ʊ������в�Ҫ���ո�
ʵ����� | ��ʼpH | ��ˮ��Ʒ���/mL | ������Һ���/mL | ����ˮ���/mL |
�� | 4.0 | 60.0 | 10.0 | 30.0 |
�� | 5.0 | 60.0 | 10.0 | 30.0 |
�� | 5.0 | 60.0 | ______ | ______ |
���ʵ��ٺ͢���Һ��Cr2O72-��Ũ����ʱ��仯��ϵ��ͼ��ʾ��
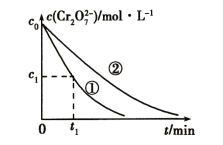
��2��������Ӧ�����ӷ���ʽΪ_______��
��3���Ա�ʵ��ٺ͢ڵĽ���ɵó�����______��ʵ�����0��t1ʱ��η�Ӧ����v(Cr3+)=_____(�ô���ʽ��ʾ)��
��4���ÿ������������[Al2Fe(SO4)4��24H2O]��������õijɷ���������¼��裬������ɼ������
����һ��Fe2+������ã�
�������___________��
������������
����Ŀ������ʵ�ˮ��Һ�д��ڵ���ƽ�⡣
��1�������dz��������ᡣ
�ٴ�����ˮ��Һ�еĵ��뷽��ʽΪ____________��
�����з����У�����ʹ������Һ��CH3COOH����̶��������_______������ĸ��ţ���
a �μ�����Ũ���� b ����Һ c ��ˮϡ�� d �������������ƾ���
��2���±�Ϊijͬѧ����25��ʱ���ס���������Һ��pH��
�� | �� | |
pH | 11 | 11 |
��Һ | ��ˮ | ����������Һ |
�ټ���Һ�е�c(OH-) =___________mol/L��
��25��ʱ��������ļס�������Һ���Ũ�ȵ����ᷴӦ�����ĵ������������_____�ҡ�
�ۼס�����Һ����ˮϡ��10����������Һ��pH����_____�ҡ�
��3����֪��Ԫ������ˮ��Һ�еĵ����Ƿֲ����еģ��ҵ�һ���ĵ���̶ȴ��ڵڶ����ĵ���̶ȣ��ڶ����ĵ���̶�Զ���ڵ������ĵ���̶���������HA��H2B��H3C�������ᣬ��������ǿ�� + �������� = ��ǿ���� + ���������ķ�Ӧ���ɣ�����֮���ܷ������з�Ӧ��
a.HA + HC2-(����) = A-+ H2C-
b.H2B(����) + 2A- = B2- + 2HA
c.H2B(����) + H2C- = HB-+ H3C
�ش��������⣺
����ͬ�����£�HA��H2B��H3C�������У�������ǿ����_____________��
�����з�Ӧ�����ӷ���ʽ��ȷ����____________��
A.H3C +3A- = 3HA + C3- B.HB- +A- = HA + B2-
��������з�Ӧ�����ӷ���ʽ��
a.H3C + OH-(����)����__________________��b.HA(����) + C3- ����_____________________��
����Ŀ����п����Ҫ�ɷ�ZnS����Cd��Fe��Cu��Ԫ������)��ұ��п���ʵ�ԭ�ϣ������ֳ�����ұ����ʽ������п��ʪ����п�����ַ������Ƚ���п����ȱ��գ��õ���ZnOΪ��Ҫ�ɷֵı�ɰ���ٷֱ�����·�ߵõ�����п��ͬʱ�õ�����Ʒ��
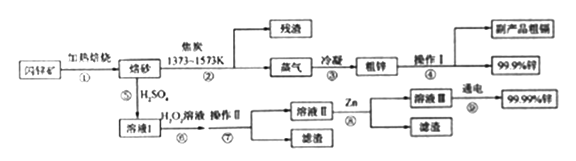
��֪��
(I)��ؽ������ʵ��۷е�
�������� | Zn | Fe | Cu | Cd |
�۵�(K) | 693 | 1812 | 1356 | 594 |
�е�(K) | 1180 | 3023 | 2840 | 1040 |
(II)�������������������������pH
��ʼ����pH | ��ȫ���� pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
��ش���������:
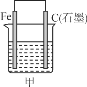
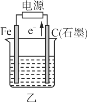
(1)д������ٷ�������Ҫ��Ӧ�Ļ�ѧ����ʽ___________________��
(2)���������̿��ZnO(s)��Ӧ����1mol COʱ����akJ����������д���÷�Ӧ���Ȼ�ѧ����ʾ________________��
(3)������в���I�ķ��뷽��Ϊ_______���õ�����Ʒ�� ��������¶�Ϊ_____���ҡ�
(4)������������ҺpHΪ_______��Ŀ����__________��
(5)�������PtΪ������AlΪ�������е��Ļ�ѧ����ʽΪ__________��
(6)�ֱ�ȡ��п��200kg��ͨ������п�õ�Zn������Ϊ65kg��ͨ��ʪ����п�õ�Zn������Ϊ78kg����п����ZnS����������ԼΪ________��