��Ŀ����
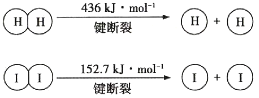
����Ŀ���ȱ���Ⱦ�ϡ�ҽҩ���л��ϳɵ��м��壬����Ҫ���л�������Ʒ����ϳɷ�Ӧԭ���ǣ�C6H6+Cl2![]() C6H5Cl+HCl
C6H5Cl+HCl
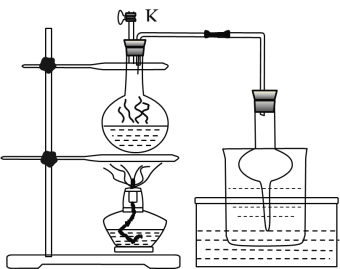
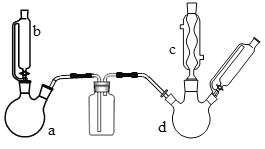
ijʵ������ȡ�ȱ���װ����ͼ��ʾ�����Ⱥͼг�װ������ȥ����
��ش��������⣺
(1)����a��b��ϳ���ȡ������װ�ã���Ӧ����Ҫ���ȣ�������a�еĹ��巴Ӧ����__���ѧʽ����
(2)�����������ͨ��װ��40mL�����ܶ�0.88g/mL���ķ�Ӧ��d�У�������м����������ά�ַ�Ӧ�¶���50��60�棬����40���ӡ�������d���ȵķ�����__��
(3)����c��������___������c���ڵ�����ɷ���HCl��Cl2��__��
(4)��d�е�Һ�嵹���Һ©���У��ֱ�������ˮ��NaOH��Һϴ�ӣ�������IJ����������������õ�24g�������ȱ���
�ټ�ϴ֮ǰҪ����ˮϴ����Ŀ����__��
����10%NaOH��Һ��ϴʱ����������ԭ��Ӧ�Ļ�ѧ����ʽΪ__��
�۸�ʵ�������ȱ��IJ���Ϊ__������С�����һλ�����ò��ʵ������۲��ʵ�ԭ��___����д��������
���𰸡�KMnO4 ˮԡ���� ���������� ������ ϴȥ��Ʒ�е�FeCl3��HCl����ʡ������������ͳɱ� Cl2��2NaOH=NaCl��NaClO��H2O 47.2%����47.3%�� �ȱ�����ȡ����������ʧ���и���Ӧ����
��������
����a��b��ϳ���ȡ������װ�ã���Ӧ����Ҫ���ȣ���ӦΪKMnO4��Ũ���ᷴӦ��Cl2��������Ӧ�Ļ�ѧ����ʽΪ2KMnO4+16HCl(Ũ)=2KCl+2MnCl2+5Cl2��+8H2O��a��d���ϴ��ƿ��Ӧװ��Ũ���ᣬ���ڳ�ȥCl2�л��е�ˮ��������d�У�����������ͨ��װ��40mL�����ܶ�0.88g/mL���ķ�Ӧ��d�У�������м��������������Ҫά�ַ�Ӧ�¶���50��60���������������ˮԡ���ȡ����ɵ��ȱ��л��б���Cl2��HCl��FeCl3�ȣ���ˮϴȥ��HCl��FeCl3�ȣ�����NaOHϴ�ӣ�ȥ��Cl2��Ȼ���Һ���ٽ��������Ա��ô������ȱ���
(1)����a��b��ϳ���ȡ������װ�ã���Ӧ����Ҫ���ȣ���ӦΪ����KMnO4��Ũ���ᷴӦ��ȡ������������a�еĹ��巴Ӧ����KMnO4����Ϊ��KMnO4��
(2)����ά�ַ�Ӧ�¶���50��60�������Կ�������ˮԡ���ȣ�������d���ȵķ�����ˮԡ���ȡ���Ϊ��ˮԡ���ȣ�
(3)����c�����������������ܣ����ӷ�����������c���ڵ�����ɷ���HCl��Cl2�ͱ���������Ϊ�����������ܣ���������
(4)����HCl��FeCl3������ˮ��Ϊ��ʡ��Һ���ڼ�ϴ֮ǰҪ����ˮϴ����Ŀ����ϴȥ��Ʒ�е�FeCl3��HCl����ʡ������������ͳɱ�����Ϊϴȥ��Ʒ�е�FeCl3��HCl����ʡ������������ͳɱ�
����10%NaOH��Һ��ϴʱ����ҪϴȥCl2��Cl2��NaOH��Һ��Ӧ������NaCl��NaClO�ȣ�����������ԭ��Ӧ�Ļ�ѧ����ʽΪCl2��2NaOH=NaCl��NaClO��H2O����Ϊ��Cl2��2NaOH=NaCl��NaClO��H2O��
�۱���������Ӧ���ȱ���ѧ����ʽΪ![]() +Cl2
+Cl2![]()
![]() +HCl�����������Ƶ��ȱ�������Ϊ
+HCl�����������Ƶ��ȱ�������Ϊ![]() =50.77g����ʵ�������ȱ��IJ���Ϊ
=50.77g����ʵ�������ȱ��IJ���Ϊ![]() =47.2%����47.3%�����ò��ʵ������۲��ʵ�ԭ���ȱ�����ȡ����������ʧ���и���Ӧ��������Ϊ��47.2%����47.3%�����ȱ�����ȡ����������ʧ���и���Ӧ������
=47.2%����47.3%�����ò��ʵ������۲��ʵ�ԭ���ȱ�����ȡ����������ʧ���и���Ӧ��������Ϊ��47.2%����47.3%�����ȱ�����ȡ����������ʧ���и���Ӧ������

 Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д�