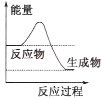
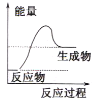
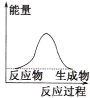
��Ŀ����
����Ŀ������ʵ�ˮ��Һ�д��ڵ���ƽ�⡣
��1�������dz��������ᡣ
�ٴ�����ˮ��Һ�еĵ��뷽��ʽΪ____________��
�����з����У�����ʹ������Һ��CH3COOH����̶��������_______������ĸ��ţ���
a �μ�����Ũ���� b ����Һ c ��ˮϡ�� d �������������ƾ���
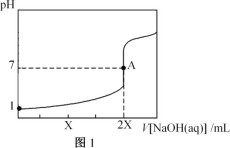
��2���±�Ϊijͬѧ����25��ʱ���ס���������Һ��pH��
�� | �� | |
pH | 11 | 11 |
��Һ | ��ˮ | ����������Һ |
�ټ���Һ�е�c(OH-) =___________mol/L��
��25��ʱ��������ļס�������Һ���Ũ�ȵ����ᷴӦ�����ĵ������������_____�ҡ�
�ۼס�����Һ����ˮϡ��10����������Һ��pH����_____�ҡ�
��3����֪��Ԫ������ˮ��Һ�еĵ����Ƿֲ����еģ��ҵ�һ���ĵ���̶ȴ��ڵڶ����ĵ���̶ȣ��ڶ����ĵ���̶�Զ���ڵ������ĵ���̶���������HA��H2B��H3C�������ᣬ��������ǿ�� + �������� = ��ǿ���� + ���������ķ�Ӧ���ɣ�����֮���ܷ������з�Ӧ��
a.HA + HC2-(����) = A-+ H2C-
b.H2B(����) + 2A- = B2- + 2HA
c.H2B(����) + H2C- = HB-+ H3C
�ش��������⣺
����ͬ�����£�HA��H2B��H3C�������У�������ǿ����_____________��
�����з�Ӧ�����ӷ���ʽ��ȷ����____________��
A.H3C +3A- = 3HA + C3- B.HB- +A- = HA + B2-
��������з�Ӧ�����ӷ���ʽ��
a.H3C + OH-(����)����__________________��b.HA(����) + C3- ����_____________________��
���𰸡�CH3COOH![]() CH3COO- + H+ bc 0.001 > > H2B B H3C+3OH-(����)= C 3-+3H 2O 2HA(����)+C 3- = 2A-,+H 2C-
CH3COO- + H+ bc 0.001 > > H2B B H3C+3OH-(����)= C 3-+3H 2O 2HA(����)+C 3- = 2A-,+H 2C-
��������
��1���ٴ�����һԪ���ᣬ��ˮ��Һ�в��ֵ������ɴ�������Ӻ������ӣ�
�ڼ�ˮϡ�͡�����ʹ��ᷴӦ�����ʻ���ȶ��ٽ�������룻
��2���ټ���Һ�е�c(OH-) =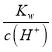 ��
��
�ڰ�ˮ�д��ڵ���ƽ�⣬�к͵ζ�ʱδ�����NH3H2O��������룻
�ۼ�ˮϡ�ʹٽ�����ƽ�������ƶ������������Һ��pH�仯С��
��3���ٸ�����Ŀ�е���Ϣ���ж�����˳��һ������̶�Զ���ڵڶ�������̶ȣ��ڶ�������̶�Զ���ڵ���������̶ȣ��õ�H2B��HB-��H3C��H2C-��HC2-������֮���ܷ������з�Ӧ��
��HA+HC2-��������=A-+H2C-
��HA��H2C-��ͬʱ����ʹHA������Ҳֻ������H2C-��������H3C��˵��HA��H3C��
��H2B��������+2A-=2HA+B2-
��H2B��HA��ͬʱ������H2B���٣�������B2-����˵��H2B��2��H+������A-����HB-Ҳ�ܽ�H+��A-����˵��H2B��HB-��HA��
��H2B��������+H2C-=HB-+H3C
��H2B��H3C����������HB-����˵��HB-���ܽ�H+�ṩ����HB-��H3C����H2B��H3C��HB-,
�ۺϣ��õ�H2B��H3C��HB-��HA��H2C-��HC2-��
��ǿ���ܺ������η�Ӧ�������
��a. ��Ԫ������Ӧ�������κ�ˮ��b. ����HA��C3-��Ӧ��H2C-��A-��
��1���ٴ�����һԪ���ᣬ��ˮ��Һ�в��ֵ������ɴ�������Ӻ������ӣ�����뷽��ʽΪCH3COOH![]() CH3COO-+H+��
CH3COO-+H+��
�ڼ�ˮϡ�͡�����ʹ��ᷴӦ�����ʻ���ȶ��ٽ�������룬�������������ƶ�����ͬ����ЧӦ�����ƴ�����룬��ѡbc��
��2���ټ���Һ�е�c(OH-) =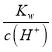 =
=![]() mol/L=0.001mol/L��
mol/L=0.001mol/L��
�ڰ�ˮ�д��ڵ���ƽ�⣬�к͵ζ�ʱδ�����NH3H2O��������룬�������ļס�������Һ���Ũ�ȵ����ᷴӦ�����ĵ�����������ף��ң�
��NH3H2O��������ʣ���ˮϡ�ʹٽ�����ƽ�������ƶ������������Һ��pH�仯С����ס�����Һ����ˮϡ��10����������Һ��pH���ף��ң�
��3���ٸ�����Ŀ�е���Ϣ���ж�����˳��һ������̶�Զ���ڵڶ�������̶ȣ��ڶ�������̶�Զ���ڵ���������̶ȣ��õ�H2B��HB-��H3C��H2C-��HC2-����֮���ܷ������з�Ӧ��
��HA+HC2-��������=A-+H2C-����HA��H2C-��ͬʱ����ʹHA������Ҳֻ������H2C-��������H3C��˵��HA��H3C��
��H2B��������+2A-=2HA+B2-����H2B��HA��ͬʱ������H2B���٣�������B2-����˵��H2B��2��H+������A-����HB-Ҳ�ܽ�H+��A-����˵��H2B��HB-��HA��
��H2B��������+H2C-=HB-+H3C��
��H2B��H3C����������HB-����˵��HB-���ܽ�H+�ṩ����HB-��H3C����H2B��H3C��HB-��
�ۺ���Ϣ�õ�H2B��H3C��HB-��HA��H2C-��HC2-��������ǿ����ΪH2B��
�ڸ���H2B��H3C��HB-��HA��H2C-��HC2-���Լ�ǿ���������ԭ�����ӷ���ʽΪ��A��H3C+A-=HA+H2C-���ʴ���B��HB-+A-=HA+B2-������ȷ��
�ʴ�ΪB��
��a. H3C�����OH-�ܹ���ȫ�кͣ�����C3-��H2O�����ӷ���ʽΪH3C+3OH-���������TC3-+3H2O��
b. ����H2B��H3C��HB-��HA��H2C-��HC2-������HA��C3-��Ӧ����H2C-��2A-����Ӧ�����ӷ���ʽΪ2HA��������+C3-�TH2C-+2A-��

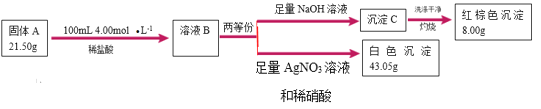
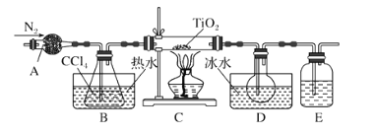
����Ŀ����ʽ������[Fe(OH)SO4]��һ��������ˮ����������Ч����������ҽҩ��Ҳ���������������������Ѫ����ҵ�����÷���м�����������������������ȣ�������ʽ�������Ĺ���������ͼ��
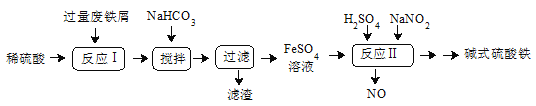
��֪������������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
��ʼ���� | 2.0 | 5.9 | 3.7 |
��ȫ���� | 3.5 | 8.4 | 4.7 |
��ش��������⣺
(1)�ù���������������������__��д����ӦI�з���������ԭ��Ӧ�����ӷ���ʽ__��
(2) ������������Ҫ�ɷ���__���ѧʽ������������NaHCO3��Ŀ���ǵ���pH��__��Χ�ڡ�
(3)��Ӧ���м���NaNO2�����ӷ���ʽΪ__����ʵ�������У�����ͬʱͨ��O2�Լ���NaNO2�������������뷴Ӧ��O2��5.6L������������������൱�ڽ�ԼNaNO2��Mr=69������__g��
(4)��ʽ����������ˮ�����ɵ�Fe(OH)2+���ӿɲ���ˮ��ΪFe2(OH)![]() �ۺ����ӣ���ˮ�ⷴӦ�����ӷ���ʽΪ__��
�ۺ����ӣ���ˮ�ⷴӦ�����ӷ���ʽΪ__��
(5)Ϊ�ⶨ��Fe2+��Fe3+��Һ����Ԫ�ص��ܺ�����ʵ��������£�ȡ25.00mL��Һ��ϡ�͵�250mL��ȷ��ȡ20.00mL�ڴ�����ƿ�У���������H2O2������pH<2�����ȳ�ȥ����H2O2���������KI��ַ�Ӧ��������0.01000mol��L-1Na2S2O3����Һ�ζ����յ㣬���ı���Һ20.00mL����֪��2Fe3++2I-==2Fe2++I2��2![]() +I2==2I-+
+I2==2I-+![]()
����Һ����Ԫ�ص��ܺ���Ϊ__g��L-1��