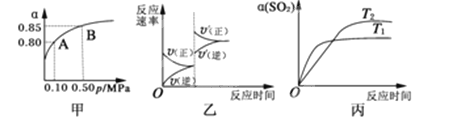
题目内容
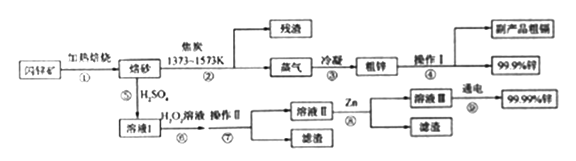
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。
【答案】2ZnS + 3O2 ![]() 2ZnO + 2SO2 ZnO(s) + C(s)
2ZnO + 2SO2 ZnO(s) + C(s) ![]() Zn(g) + CO (g) △H = + a kJ/mol 蒸馏 1040 K 3.2 < pH < 5.9 除去溶液中的Fe3+ 2ZnSO4 + 2H2O
Zn(g) + CO (g) △H = + a kJ/mol 蒸馏 1040 K 3.2 < pH < 5.9 除去溶液中的Fe3+ 2ZnSO4 + 2H2O ![]() 2Zn + O2↑+ 2H2SO4 48.5%
2Zn + O2↑+ 2H2SO4 48.5%
【解析】
(1)本题考查化学反应方程式的书写,根据闪锌矿的主要成分,因此反应①的主要反应是2ZnS+3O2![]() 2ZnO+2SO2,金属单质转化成相应的氧化物;(2)本题考查热化学反应方程式的书写,反应的方程式为ZnO+C
2ZnO+2SO2,金属单质转化成相应的氧化物;(2)本题考查热化学反应方程式的书写,反应的方程式为ZnO+C![]() CO+Zn,生成1molCO时,吸收热量akJ,因此热化学反应方程式为:ZnO(s) + C(s)
CO+Zn,生成1molCO时,吸收热量akJ,因此热化学反应方程式为:ZnO(s) + C(s) ![]() Zn(g) + CO (g) △H = + a kJ/mol;(3)本题考查物质的分离和提纯,反应②,焦炭作还原剂,把金属从其氧化物中还原出来,根据金属的熔沸点,②反应的温度是1373~1573K,此时Zn和Cd是蒸气,粗锌的成分是Zn和Cd,利用其沸点不同,对粗锌加热,温度控制在1040K左右,让Cd转化成蒸气,达到分离的目的,因此此方法是蒸馏;(4)本题考查物质的除杂,根据表格II的数据,以及流程图,锌元素以离子形式存在,因此pH控制在3.2到5.9之间,目的是除去Fe3+;(5)根据流程图,电解得到99.99%的锌单质,采用的方法是电解,因此反应方程式为2ZnSO4 + 2H2O
Zn(g) + CO (g) △H = + a kJ/mol;(3)本题考查物质的分离和提纯,反应②,焦炭作还原剂,把金属从其氧化物中还原出来,根据金属的熔沸点,②反应的温度是1373~1573K,此时Zn和Cd是蒸气,粗锌的成分是Zn和Cd,利用其沸点不同,对粗锌加热,温度控制在1040K左右,让Cd转化成蒸气,达到分离的目的,因此此方法是蒸馏;(4)本题考查物质的除杂,根据表格II的数据,以及流程图,锌元素以离子形式存在,因此pH控制在3.2到5.9之间,目的是除去Fe3+;(5)根据流程图,电解得到99.99%的锌单质,采用的方法是电解,因此反应方程式为2ZnSO4 + 2H2O ![]() 2Zn + O2↑+ 2H2SO4;(6)湿法炼锌中操作⑧加入锌单质,因此湿法炼锌得到锌不完全来自于闪锌矿,因此计算质量分数用火法炼锌中得到锌进行计算,根据锌元素守恒,因此ZnS的质量分数为65×97/(65×200)×100%=48.5%。
2Zn + O2↑+ 2H2SO4;(6)湿法炼锌中操作⑧加入锌单质,因此湿法炼锌得到锌不完全来自于闪锌矿,因此计算质量分数用火法炼锌中得到锌进行计算,根据锌元素守恒,因此ZnS的质量分数为65×97/(65×200)×100%=48.5%。

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案