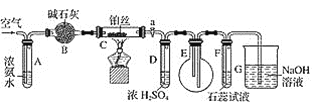
题目内容
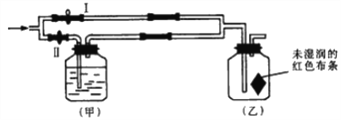
【题目】下图所示甲、乙是电化学实验装置。
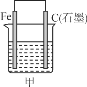
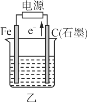
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为__________________________________。
②乙中总反应的离子方程式为____________________________________。
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为__________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________g。
【答案】2H2O+O2+4e-===4OH- 2Cl-+2H2O![]() H2↑+Cl2↑+2OH- 5Cl2+I2+6H2O === 10HCl+2HIO3 Fe-2e-=== Fe2+ CuO(或CuCO3) 0.8(或1.24)
H2↑+Cl2↑+2OH- 5Cl2+I2+6H2O === 10HCl+2HIO3 Fe-2e-=== Fe2+ CuO(或CuCO3) 0.8(或1.24)
【解析】
(1)①甲中铁作负极,石墨作正极,发生吸氧腐蚀,石墨电极反应式为O2+2H2O+4e-=4OH-;②根据电子流动方向,铁作阴极,此装置是电解饱和食盐水,因此总电极反应式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;③Cl2作氧化剂,被还原成Cl-,I2为还原剂,根据得失电子数目守恒,因此有5×2×1=1×(x-0)×2,x=5,I被氧化成HIO3,因此反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;
2OH-+H2↑+Cl2↑;③Cl2作氧化剂,被还原成Cl-,I2为还原剂,根据得失电子数目守恒,因此有5×2×1=1×(x-0)×2,x=5,I被氧化成HIO3,因此反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;
(2)①甲中发生Fe+Cu2+=Fe2++Cu,铁作负极,电极反应式为Fe-2e-=Fe2+;②乙中发生总反应是2CuSO4+2H2O![]() Cu+O2↑+2H2SO4,恢复到电解前的状态,需要加入CuO或CuCO3,pH=1此时溶液中n(H+)=200×10-3×0.1mol=0.02mol,如果加入CuO,则需要的m(CuO)=0.02×80/2g=0.8g,假如加入CuCO3,m(CuCO3)=0.02×124/2g=1.24g。
Cu+O2↑+2H2SO4,恢复到电解前的状态,需要加入CuO或CuCO3,pH=1此时溶液中n(H+)=200×10-3×0.1mol=0.02mol,如果加入CuO,则需要的m(CuO)=0.02×80/2g=0.8g,假如加入CuCO3,m(CuCO3)=0.02×124/2g=1.24g。

【题目】异丁烯![]() 是一种重要的化工原料,可由异丁烷
是一种重要的化工原料,可由异丁烷![]() 直接催化脱氢制备:
直接催化脱氢制备:
(1)已知:![]()
![]()
写出由异丁烷![]() 催化脱氢制备异丁烯
催化脱氢制备异丁烯![]() 的热化学方程式。_________。
的热化学方程式。_________。
(2)一定条件下,以异丁烷为原料催化脱氢生产异丁烯。温度、压强的改变对异丁烷平衡转化率的影响如图所示。

①判断![]() 、
、![]() 的大小关系:
的大小关系:![]() _____________
_____________![]() (填“>”或“<”);能使单位时间内异丁烯的产量提高,又能使异丁烷平衡产率提高,应采取的措施是____________(填标号)。
(填“>”或“<”);能使单位时间内异丁烯的产量提高,又能使异丁烷平衡产率提高,应采取的措施是____________(填标号)。
a.升高温度 b.降低温度 c.增大压强 d.降低压强 e.使用催化剂
②平衡常数的表达式中的平衡浓度可以用平衡时各气体的分压代替(气体a的分压=气体a的物质的量分数×总压强,即![]() (总)。求图中的A点状态下的异丁烷脱氢反应的平衡常数
(总)。求图中的A点状态下的异丁烷脱氢反应的平衡常数![]() _____________(保留两位有效数字)。
_____________(保留两位有效数字)。
(3)温度对催化剂的活性和目标产物的选择性都有一定的影响。下表是以![]() 为催化剂,在反应时间相同时,测得的不同温度下的数据。
为催化剂,在反应时间相同时,测得的不同温度下的数据。
温度/℃ | 550 | 570 | 590 | 610 | 630 |
异丁烷转化率/% | 13.8 | 24.5 | 25.6 | 30.0 | 33.3 |
异丁烯选择性/% | 93.9 | 88.3 | 95.0 | 80.4 | 71.2 |
异丁烯的产率/% | 12.9 | 21.6 | w | 24.1 | 23.7 |
已知①选择性![]() ;②异丁烷高温下裂解生成短碳链烃类化合物
;②异丁烷高温下裂解生成短碳链烃类化合物
①590℃时异丁烯的产率![]() _____________×100%。
_____________×100%。
②在590℃之前异丁烯的产率随温度升高而增大的原因可能是____________、_____________。
③590℃之后,异丁烯产率降低的主要原因可能是_____________。