题目内容
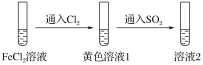
【题目】为验证还原性:SO2>Fe2+>Cl-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有( )
溶液1 | 溶液2 | |
甲 | 含Fe3+、Fe2+ | 含SO |
乙 | 含Fe3+,无Fe2+ | 含SO |
丙 | 含Fe3+,无Fe2+ | 含Fe2+ |
A.只有甲B.甲、乙
C.甲、丙D.甲、乙、丙
【答案】C
【解析】
本实验利用“还原剂的还原性大于还原产物”的原理来验证还原性的强弱顺序。向FeCl2溶液中通入Cl2,得到溶液1,再向溶液1中通入SO2,得到溶液2。
甲.溶液1中含有Fe3+、Fe2+,说明发生反应2Fe2++Cl2=2Fe3++2Cl-,且Cl2反应完全,可证明还原性Fe2+>Cl-;溶液2中含有SO42-,则说明发生反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,可证明还原性SO2>Fe2+,故甲能证明还原性SO2>Fe2+>Cl-;
乙.溶液1中含有Fe3+,无Fe2+剩余,则还原性Fe2+>Cl-,但Cl2可能过量,再通入SO2,可能发生的反应是Cl2+SO2+2H2O=2Cl-+SO42-+4H+,不能比较SO2与Fe2+的还原性强弱,故乙不能验证;
丙.溶液1中含有Fe3+,没有Fe2+,通入SO2后溶液中又含有Fe2+,说明SO2将Fe3+还原得到Fe2+,证明还原性SO2>Fe2+,故丙实验结论能证明还原性SO2>Fe2+>Cl-。
综上所述,答案为C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目