题目内容
【题目】Bodensteins 研究了反应 2HI(g)![]() I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
A.反应物浓度越大,正反应速率越大
B.生成物浓度越大,逆反应速率越大
C.该反应的平衡常数K =k正/k逆
D.速率常数的大小与反应程度无关系
【答案】D
【解析】
A. 有正反应速率为υ正=k正c2(HI)得, 反应物浓度越大,正反应速率越大,故A正确;
B. 有逆反应速率为υ逆=k逆c(I2)·c(H2)得, 生成物浓度越大,逆反应速率越大,故B正确;
C.反应达到平衡状态后,正逆反应速率相等,即是k正c2(HI)= k逆c(I2)·c(H2),k正/k逆= c(I2)·c(H2)/ c2(HI)= K,故C正确;
D. 速率常数的大小反映了可逆反应进行的程度,故D错误;
故选:D。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如下(所取溶液体积均为2 mL):
实验编号 | 温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
Ⅰ | 25 | 0.1 | 0.1 |
Ⅱ | 25 | 0.2 | 0.1 |
Ⅲ | 50 | 0.2 | 0.1 |
①上述实验中溶液最先变浑浊的是______(填实验编号,下同)。
②为探究浓度对化学反应速率的影响,应选择______和______。
(2)某温度下,在1 L密闭容器中,发生反应:2X(g)+Y(g)![]() 2Z(g),X的物质的量随时间的变化如下表:
2Z(g),X的物质的量随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
X的物质的量/mol | 0.02 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
①用X的浓度变化表示0~2 s的平均化学反应速率为______mol/(L·s)。
②在3 s以后X的浓度不再改变,反应达到了______状态。
③能说明该反应已达到化学平衡状态的是______(填序号)。
A.v正(X)=v逆(X)
B.单位时间内有2 mol X生成同时有1 mol Y生成
C.X、Y、Z的分子数之比为2∶1∶2
【题目】为验证还原性:SO2>Fe2+>Cl-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有( )
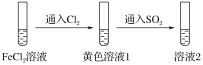
溶液1 | 溶液2 | |
甲 | 含Fe3+、Fe2+ | 含SO |
乙 | 含Fe3+,无Fe2+ | 含SO |
丙 | 含Fe3+,无Fe2+ | 含Fe2+ |
A.只有甲B.甲、乙
C.甲、丙D.甲、乙、丙