题目内容
【题目】常温下,在20mL0.1mol/L HR 溶液中滴加0.1000mol/LNaOH溶液,混合溶液的PH与所加NaOH溶液体积的关系如图所示。下列推断正确的是
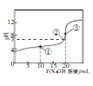
A. ①、②、③三点中,③对应的溶液中c水(H+)·c水(OH-)最大
B. HR溶液中只存在H+、R-、OH-、H2O四种微粒
C. ②点溶液中一定存在c(Na+)>c(R-)>c(H+)=c(OH-)
D. NaR的水解常数Ka和水解程度:③>②>①
【答案】A
【解析】A、根据图像可知点①HR被中和一半,此时得到的溶液是等浓度的NaR和HR的混合物,②点所示的溶液显示中性,此时得到的是NaR和剩余的少量的HR的混合物,点③恰好反应,得到的是NaR溶液,此时溶液显碱性,说明是强碱弱酸盐,R-水解,因此③对应的溶液中c水(H+)·c水(OH-)最大,A正确;B、HR是弱酸,溶液中只存在H+、R-、OH-、H2O、HR五种微粒,B错误;C、②点显中性,溶液中一定存在c(Na+)=c(R-)>c(H+)=c(OH-),C错误;A、水解常数只与温度有关系,D错误;答案选A。

【题目】镁及其化合物在现代工业中有着广泛的用途。
(1)组成为Mg17Al12的镁铝合金是一种潜在的贮氢材料,当其贮氢最达到最大值时组成变为“17MgH2+12Al”,则Mg、Al、Mg17Al12三种物质按熔点由高到低的顺序排列为_______, 1mol“17MgH2+12Al”与足量Na0H溶液反应时生成的气体的质量是___________g。
(2)镁可与SiO2发生多种反应,且条件不同时得到的产物也不同。当二者在高温条件下发生置换反应时.还原产物是_________,若镁过量,则产物为两种镁的二元化合物,写出反应的化学方程式:______。
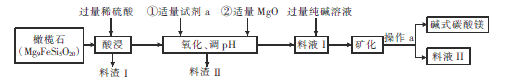
(3)碱式碳酸镁[MgCO3·3H2O]是重要的化工原料,下图表示的是制备它的一种工艺流程。
开始沉淀时的PH | 完全沉淀时的pH | |
Fe(OH)3 | 2.7 | 3.7 |
Mg(OH)2 | 9.7 | 11 |
① Mg9FeSi5O20中铁元素的化合价为____,pH的调节范围是______.
② 试剂a是一种常用的绿色氧化剂,加入a后反应的离子方程式为__________。
③ 写出料渣Ⅱ的一种用途:______。一般认为c(Mg2+)≤1×10-5mol/L时,Mg2+已完全沉淀,则Mg(OH)2的Ksp=______。写出生成碱式碳酸镁的离子方程式:____________。