题目内容
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。完成下列填空:
(1)锂位于元素周期表的________。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_________。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式_______________,LiH中阴离子半径大于阳离子半径,其原因是__________________________________________________。
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有________种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_____________________。
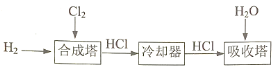
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+(___) __________。
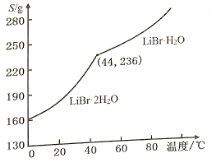
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:_____、过滤、用乙醇洗涤,干燥。
【答案】第二周期ⅠA族 锂与镁在元素周期表中位置属于对角线关系,同主族金属性钠大于锂,同周期金属性钠大于镁,锂和镁金属性相似,以此化学性质相似 ![]() :
:![]()
![]() 和
和![]() 核外电子数相同,核内质子数
核外电子数相同,核内质子数![]() 大于
大于![]() ,其原子核对核外电子的吸引力大,因此离子半径小于
,其原子核对核外电子的吸引力大,因此离子半径小于![]() 3 2p
3 2p ![]() 蒸发浓缩、冷却至
蒸发浓缩、冷却至![]() 左右结晶
左右结晶
【解析】
(1)锂的原子序数为3,锂与镁在元素周期表中位置属于对角线关系;
(2)氢化锂是由Li+和H—组成的离子化合物,Li+和H—的电子层结构相同,核外电子数相同;
(3)碳原子的核外电子排布式为1s22s22p2;
(4)①两种参与大气循环的气体应为N2和CO2,根据得失电子守恒、原子守恒配平化学方程式;
②由题图可知,当低于44 ℃结晶时要得到LiBr·2H2O。
(1)锂的原子序数为3,位于元素周期表第二周期ⅠA族;锂与镁在元素周期表中位置属于对角线关系,同主族金属性钠大于锂,同周期金属性钠大于镁,锂和镁金属性相似,以此化学性质相似,故答案为:第二周期ⅠA族;锂与镁在元素周期表中位置属于对角线关系,同主族金属性钠大于锂,同周期金属性钠大于镁,锂和镁金属性相似,以此化学性质相似;
(2)氢化锂是由Li+和H—组成的离子化合物,H—的电子式![]() ;Li+和H—的电子层结构相同,核外电子数相同,核电荷数越大,其原子核对核外电子的吸引力大,因此Li+离子半径小于H—,故答案为:
;Li+和H—的电子层结构相同,核外电子数相同,核电荷数越大,其原子核对核外电子的吸引力大,因此Li+离子半径小于H—,故答案为:![]() ;Li+和H—的核外电子数相同,核内质子数Li+大于H—,其原子核对核外电子的吸引力大,因此Li+离子半径小于H—;
;Li+和H—的核外电子数相同,核内质子数Li+大于H—,其原子核对核外电子的吸引力大,因此Li+离子半径小于H—;
(3)碳原子的核外电子排布式为1s22s22p2,所以有3种能量不同的电子,纺锤形轨道p上有2个电子,所以有2个纺锤形轨道,故答案为:3;2;
(4)①Br2、Li2CO3和NH3·H2O反应生成的两种参与大气循环的气体应为N2和CO2,根据得失电子守恒、原子守恒配平化学方程式3Br2+3Li2CO3+2NH3·H2O=6LiBr+N2↑+3CO2↑+5H2O,故答案为:3Br2+3Li2CO3+2NH3·H2O![]() 6LiBr+N2↑+3CO2↑+5H2O;
6LiBr+N2↑+3CO2↑+5H2O;
②由题图可知,当低于44 ℃结晶时要得到LiBr·2H2O,若要制得LiBr·H2O,需将温度冷却到44 ℃结晶、44 ℃过滤、乙醇洗涤(LiBr·H2O易溶于水,选用乙醇洗涤可以减少洗涤过程中因溶解造成的损失)、干燥,故答案为:蒸发浓缩、冷却至44 ℃结晶。

 阅读快车系列答案
阅读快车系列答案