��Ŀ����
����Ŀ����ʵ�����У��������������ַ����Ʊ���������(ClO2)���ش���������
��.![]()
��.![]()
(1)NaClO3��Cl�Ļ��ϼ�Ϊ______________��
(2)���л�ԭ������______________��
(3)������ӷ���ʽΪ__________________________________________������Ӧ����0.1mol����ת�ƣ��������ClO2�����ڱ�״���µ����Ϊ_____________L��
(4)����������һ����ˮ�����ȷ����й㷺Ӧ�õĸ�Ч��ȫ������������Ч�Ⱥ��������������������������������������䶨���ǣ�ÿ�˺�������������������(��ʧ������)�൱�ڶ��ٿ�C12����������(Cl��ת��ΪCl-)��ClO2����Ч�Ⱥ���Ϊ_________________(������������λС��)
���𰸡�+5 ClO2 2ClO3-+H2O2+2H+=2ClO2��+O2��+2H2O 2.24 2.63g
��������
�����������ϼ۴�����Ϊ0���㣻����������ԭ��Ӧ�ĸ�����Ԫ�صĻ��ϼ۱仯�����жϣ���ϵ���ת�Ƶ���Ŀ���㣻���ݵ����غ���ɼ��㡣
(1)NaClO3��NaΪ+1�ۣ�OΪ-2�ۣ����������ϼ۴�����Ϊ0��֪Cl�Ļ��ϼ�Ϊ+5�ۣ�
(2)����ClԪ�ش�+5�۽�Ϊ+4�ۣ���-1������Ϊ0�ۣ���ԭ������ClO2��
(3)������ӷ���ʽΪ2ClO3-+H2O2+2H+=2ClO2��+O2��+2H2O����Ӧ��ClԪ�ش�+5�۽�Ϊ+4�ۣ���ÿ����1molClO2ת��1mol���ӣ��ַ�Ӧ����0.1mol����ת�ƣ�������ClO2��������ʵ���Ϊ0.1mol���ڱ�״���µ����Ϊ0.1mol��22.4L/mol=2.24L��
(4) ������Ч�ȶ��壬1gClO2�����ʵ���Ϊ![]() mol����֪ClO2��Cl-��5e-����ת�Ƶ���Ϊ
mol����֪ClO2��Cl-��5e-����ת�Ƶ���Ϊ![]() mol����֪Cl2��2Cl-��2e-�����ݵ���ת����Ŀ��ȣ���֪���������ʵ���Ϊ
mol����֪Cl2��2Cl-��2e-�����ݵ���ת����Ŀ��ȣ���֪���������ʵ���Ϊ![]() ��
��![]() mol��������������Ϊ
mol��������������Ϊ![]() ��
��![]() mol��71g/mol=2.63g��
mol��71g/mol=2.63g��

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�����Ŀ����ѧ��Ӧ�����ʺ��ȶ�����������������Ҫ�����塣
(1)��֪Na2S2O3��H2SO4=Na2SO4��S����SO2��H2O����ͬѧͨ���ⶨ�÷�Ӧ����ʱ��Һ����ǵ�ʱ�䣬�о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬���ʵ������(��ȡ��Һ�����Ϊ2 mL)��
ʵ���� | �¶�/�� | c(Na2S2O3)/mol��L��1 | c(H2SO4)/mol��L��1 |
�� | 25 | 0.1 | 0.1 |
�� | 25 | 0.2 | 0.1 |
�� | 50 | 0.2 | 0.1 |
������ʵ������Һ���ȱ���ǵ���______����ʵ���ţ���ͬ����
��Ϊ̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��______��______��
(2)ij�¶��£���1 L�ܱ������У�������Ӧ��2X(g)��Y(g)![]() 2Z(g)��X�����ʵ�����ʱ��ı仯���±���
2Z(g)��X�����ʵ�����ʱ��ı仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
X�����ʵ���/mol | 0.02 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
����X��Ũ�ȱ仯��ʾ0��2 s��ƽ����ѧ��Ӧ����Ϊ______mol/(L��s)��
����3 s�Ժ�X��Ũ�Ȳ��ٸı䣬��Ӧ�ﵽ��______״̬��
����˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����______(�����)��
A��v��(X)=v��(X)
B����λʱ������2 mol X����ͬʱ��1 mol Y����
C��X��Y��Z�ķ�����֮��Ϊ2��1��2
����Ŀ��Ϊ��֤��ԭ�ԣ�SO2>Fe2��>Cl��������ͬѧ�ֱ��������ͼʵ�飬������Һ1����Һ2���������ӽ����˼��飬��֤��������ԭ��˳���ʵ������(����)
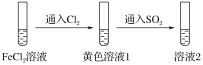
��Һ1 | ��Һ2 | |
�� | ��Fe3����Fe2�� | ��SO |
�� | ��Fe3������Fe2�� | ��SO |
�� | ��Fe3������Fe2�� | ��Fe2�� |
A.ֻ�м�B.�ס���
C.�ס���D.�ס��ҡ���
����Ŀ���±��е�ʵ������ܴﵽʵ��Ŀ�Ļ��ܵó���Ӧ���۵���![]()
ѡ�� | ʵ����� | ʵ��Ŀ�Ļ���� |
A | ��һ��Ũ�ȵ� |
|
B | ȡ���� | ���� |
C | ��ij��Һ�еμ� | ˵��ԭ��Һ��һ������ |
D | ������ | ��ȥ |
A.A