题目内容
【题目】某研究性小组探究乙酸乙酯的反应机理,实验如下:
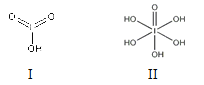
CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
乙醇 | 0.79 | -114 | 78 | 溶 |
乙酸 | 1.049 | 16.2 | 117 | 溶 |
乙酸乙酯 | 0.902 | 84 | 76.5 | 不溶 |
合成反应:
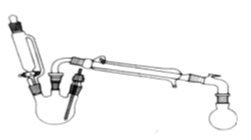
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪
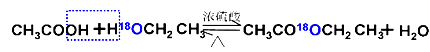
用醋酸羟基氧示踪

含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理 。
2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
【答案】(1)先加成反应生成 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成![]() 和
和 
(2)![]()
(3)B
(4)先加入乙醇后加入硫酸,边振荡加滴加。
(5)保证乙醇量是乙酸量10倍以上,提高乙酸的转化率。
(6)乙醚、乙酸、乙醇和水 pH试纸检验不显酸性 减少乙酸乙酯溶解
【解析】
试题分析:(1)根据题给信息知酯化反应的机理是先加成反应生成 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成![]() 和
和  。
。
(2)利用三段式进行计算。120 ℃时,设起始乙醇和乙酸的浓度均为1mol/L。根据题意知
CH3COOH + C2H5OH![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
起始浓度(mol/L)1 1 0 0
转化浓度(mol/L)0.65 0.65 0.65 0.65
平衡浓度(mol/L)0.35 0.35 0.65 0.65
平衡常数![]() 。
。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是冷却后补加,选B。
(4)实验室中混合两种液体时,为防止暴沸,先加入乙醇后加入硫酸,边振荡加滴加。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是保证乙醇量是乙酸量10倍以上,提高乙酸的转化率。
(6)蒸出的粗乙酸乙酯中主要有乙醚、乙酸、乙醇和水等杂质;可利用pH试纸检验混合液体不显酸性来判断乙酸是否除尽;用饱和NaCl溶液洗涤除去残留的Na2CO3溶液而不用水的原因是减少乙酸乙酯溶解。