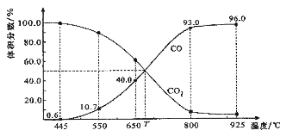
题目内容
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是
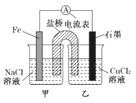
A.原电池的总反应为 Fe+Cu2+=Fe2++Cu
B.反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D.盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
【答案】D
【解析】
试题分析:A.负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-=Cu,则原电池的总反应为Fe+Cu2+═Fe2++Cu,故A正确;B.Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
12g n
解得:n=0.2mol,故B正确;C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,溶液中的氢离子在正极上得电子,则石墨电极反应式为2H++2e-═H2↑,故C正确;D.盐桥中是KNO3溶液,则盐桥中NO3-移向负极移动,即向甲烧杯,故D错误;故选D。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】只给出下列甲和乙中对应的物理量,不能求出物质的量的是( )
A | B | C | D | |
甲 | 物质中的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
乙 | 阿伏加德罗常数 | 标准状况下的气体的体积 | 固体的密度 | 溶液体积 |
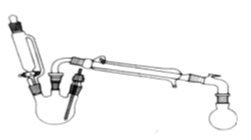
【题目】某研究性小组探究乙酸乙酯的反应机理,实验如下:
CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
乙醇 | 0.79 | -114 | 78 | 溶 |
乙酸 | 1.049 | 16.2 | 117 | 溶 |
乙酸乙酯 | 0.902 | 84 | 76.5 | 不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪
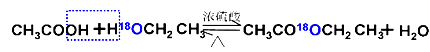
用醋酸羟基氧示踪

含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理 。
2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。