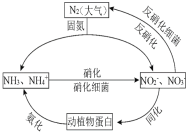
题目内容
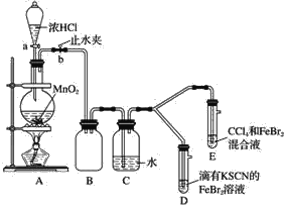
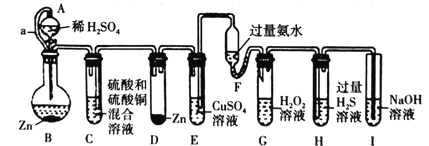
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)上述反应中生成二氧化硫的化学方程式为__。
(2)乙同学认为还可能产生氢气的理由是__。
(3)丙同学在安装好装置后,必不可少的一步操作是__。
(4)说明A、B、E中可能的试剂及其作用:
①A中加入的试剂可能是__,作用是__;
②B中加入的试剂可能是__,作用是__;
③E中加入的试剂可能是__,作用是__。
(5)可以证明气体X中含有氢气的实验现象是:C中__;D中__。
(6)如果去掉装置B,还能否根据D中的现象判断气体X中有氢气__(填“能”或“不能”),原因是__。
【答案】Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O 当锌与浓硫酸反应时,浓硫酸的浓度逐渐减小,锌与稀硫酸反应可产生氢气 检查装置的气密性 品红溶液 检验二氧化硫 浓硫酸 吸收水蒸气 碱石灰 防止空气中水蒸气进入D中 黑色(CuO)变成红色(Cu) 白色粉末变成蓝色 不能 因为混合气体中含水蒸气,会干扰氢气的检验
ZnSO4+SO2↑+2H2O 当锌与浓硫酸反应时,浓硫酸的浓度逐渐减小,锌与稀硫酸反应可产生氢气 检查装置的气密性 品红溶液 检验二氧化硫 浓硫酸 吸收水蒸气 碱石灰 防止空气中水蒸气进入D中 黑色(CuO)变成红色(Cu) 白色粉末变成蓝色 不能 因为混合气体中含水蒸气,会干扰氢气的检验
【解析】
硫酸与锌反应,硫酸浓度不同,其还原产物不同。锌与浓硫酸共热发生反应生成硫酸锌、二氧化硫(还原产物)和水,锌与稀硫酸反应生成硫酸锌、氢气(还原产物),所以浓硫酸与锌反应产生的气体可能是二氧化硫或二氧化硫和氢气的混合气体。由装置图可知,丙同学设计的实验是先检验二氧化硫,然后再检验氢气,干燥管是通过氢气的氧化产物水来判断有无氢气存在,所以检验氢气之前一定要除去气流中夹带的水分子,B装置中应该装入浓硫酸进行干燥。
(1)锌和浓硫酸反应是二氧化硫、硫酸锌和水,反应的化学方程式为Zn+2H2SO4(浓) ![]() ZnSO4+SO2↑+2H2O,因此,本题正确答案是: Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O,因此,本题正确答案是: Zn+2H2SO4(浓) ![]() ZnSO4+SO2↑+2H2O ;
ZnSO4+SO2↑+2H2O ;
(2)反应时浓H2SO4(浓)浓度逐渐变稀,Zn与稀H2SO4反应可产生H2,和硫酸锌,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;因此,本题正确答案是: 当Zn与浓硫酸反应时,浓硫酸浓度逐渐变小,Zn与稀硫酸反应可产生H2。
(3)装置是气体验证食盐,所以需要装置气密性完好,实验开始先检验装置的气密性,因此,本题正确答案是:检查装置的气密性。
(4)分析装置图可以知道,生成的气体中有二氧化硫和氢气,所以装置A是验证二氧化硫存在的装置,选品红溶液进行验证;通过高锰酸钾溶液除去二氧化硫,通过装置B中的浓硫酸除去水蒸气,利用氢气和氧化铜反应生成铜和水蒸气,所以利用装置D中 的无水硫酸铜检验水的生成,为避免空气中的水蒸气影响D装置中水的检验,装置E中需要用碱石灰,因此,本题正确答案是:品红溶液; 检验SO2; 浓硫酸;吸收水蒸气;碱石灰;防止空气中的水蒸气进入D中。
(5)证明生成的气体中含有氢气的现象,C装置中黑色氧化铜变为红色铜,D装置中白色硫酸铜变为蓝色,因此,本题正确答案是:黑色的CuO变成红色的Cu,白色粉末变成蓝色。去掉装置B,高锰酸钾溶液中的水蒸气可能会使D中出现蓝色,但不能根据此现象判断气体X中有氢气。答案:不能 . 因为混合气体中可能含水蒸气,会干扰H2的检验。

【题目】I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
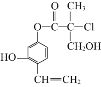
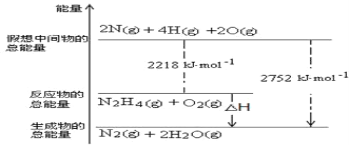
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为__________。
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/molL-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/molL-1min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲____________V丙,平衡常数K丙_________K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)H2NCOONH4(氨基甲酸铵)(l) △H1 ,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
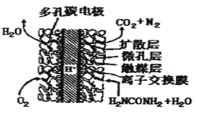
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________。