题目内容
【题目】非金属元素在化学中具有重要地位,请回答下列问题:
(1)下图的氮循环是生态系统物质循环的重要部分,人类活动加剧了氮循环中的物质转化。
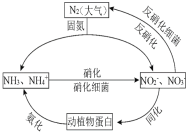
①N在元素周期表中的位置_________,![]() 的立体构型__________。
的立体构型__________。
②反硝化过程中,CH3OH可作为反应的还原剂,1mol还原剂失去6mol电子,被氧化为两种常见离子。请将该反应的离子方程式补充完整:__CH3OH+__![]()
![]() ___+___+___+___ 。
___+___+___+___ 。
(2)砷及其化合物有重要的用途。
③砷(As)简化的电子排布式___,AsH3的熔沸点比NH3的 ___(填“高”或“低”),原因是____。
④雌黄(As2S3)在我国古代常用作书写涂改修正液。分子结构如下图,则砷原子的杂化方式为_____。
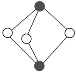
⑤砷化镓(GaAs)的熔点为1238℃,密度为ρ g·cm-3,其晶胞结构如图所示。

距Ga原子最近且等距的As原子个数为____,GaAs的摩尔质量为M g·mol-1,阿伏加德罗常数值为NA,则该晶胞边长为___pm。
【答案】第二周期第ⅤA族 V形 5 6 3N2 4HCO3- CO32- 8H2O [Ar]3d104s24p3 低 NH3的分子间存在氢键 sp3 4  ×1010
×1010
【解析】
根据原子的电子层数及其价电子数确定元素在周期表中的位置;根据原子及离子的电子排布式分析;根据价层电子对数目和价层电子对互斥理论分析原子的杂化类型和空间构型;根据晶胞结构分析晶体的化学式并进行相关计算。
(1)①N的核电荷数为7,原子核外有2个电子层,且最外层电子数是5,则N在元素周期表中的位置第二周期第ⅤA族,![]() 的N原子价层电子对数为2+
的N原子价层电子对数为2+![]() =3,则N原子的杂化方式为sp2杂化,
=3,则N原子的杂化方式为sp2杂化,![]() 的立体构型为V形;
的立体构型为V形;
②反硝化过程中,CH3OH中C元素为-2价,作为反应的还原剂,1mol还原剂失去6mol电子,则还原产物中C元素为+4价,被氧化为两种常见离子,应为CO32-和HCO3-,NO3-的还原产物为N2,根据电子守恒、电荷守恒和原子守恒可知反应的离子方程式为:5CH3OH+6NO3-![]() 3N2↑+4HCO3-+CO32-+8H2O;
3N2↑+4HCO3-+CO32-+8H2O;
(2)③砷(As)的核电荷数是33,为第四周期第ⅤA族元素,则简化的电子排布式[Ar]3d104s24p3;NH3的分子间存在氢键,则AsH3的沸点比NH3低;
④雌黄(As2S3) 中As原子的价层电子对为3+![]() =4,则砷原子的杂化方式为sp3杂化;
=4,则砷原子的杂化方式为sp3杂化;
⑤砷化镓(GaAs) 晶胞中距Ga原子最近且等距的As原子个数为4;As数目为8×![]() +6×
+6×![]() =4,Ga数目为4,则晶胞的质量为
=4,Ga数目为4,则晶胞的质量为![]() g,晶胞边长为apm=a×10-10cm,则晶胞的体积为(a×10-10cm)3,根据
g,晶胞边长为apm=a×10-10cm,则晶胞的体积为(a×10-10cm)3,根据![]() ,则a=
,则a=![]() ×1010pm=
×1010pm= ×1010pm。
×1010pm。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO 部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、
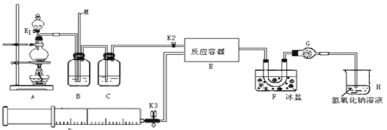
试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式__________。
(2)装置B的作用是 ①__________,②____________。
(3)若用A装置制取NO气体,B中应该盛放_________。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为___。
(5) 简述检查A、B、C所组成的实验装置气密性的操作_________。
(6)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与________________同时通入NaOH溶液中。
(7)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明 HNO2是弱酸:____________。(仅提供的试剂:1 molL-1HCl、 1 molL-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0 g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,用0.20 molL-1 AgNO3标准溶液滴定至终点,根据表中所给信息,应选用____________做指示剂,滴定终点的现象是______。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3 ×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为________。