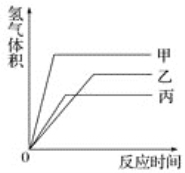
题目内容
【题目】“化学多米诺实验”是只需控制第一个反应,就能使若干化学实验依次发生,如图所示。已知:①Cu2++4NH3H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2的催化剂);②已知装置A、C中所用硫酸的浓度相同,装置B、D中所用金属锌的质量完全相同
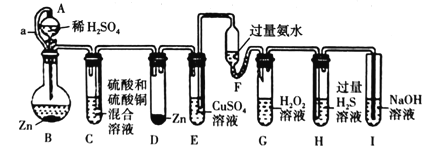
下列说法错误的是( )
A.该实验成功的关键条件是整套装置的气密性良好
B.因为形成原电池,所以装置D中生成氢气的反应速率一定大于B
C.导管a的作用是平衡A和B内气压
D.装置H中出现浅黄色浑浊,可证明非金属性:O>S
【答案】B
【解析】
B中稀硫酸和锌反应生成H2,H2进入C中,C中压强增加,把C中的硫酸和硫酸铜混合溶液挤压到D中,D中Zn和硫酸铜、硫酸反应生成Cu和H2,H2进入E中,E中压强增加,把E中的硫酸铜溶液挤压到F中,Cu2+和氨水生成蓝色Cu( OH)2沉淀,但随后转化为可溶性的[Cu(NH3)4]2+ ,被挤入到G中,促使H2O2分解,H2O2分解生成的O2进入H中和过量H2S溶液反应,生成淡黄色的S沉淀,挥发出的H2S气体被NaOH溶液吸收,避免污染空气。
A.该实验是通过改变装置内气压引发后续反应,在装置气密性良好的前提下才能进行,A正确;
B.由于铜离子的氧化性强于氢离子,故锌先和铜离子发生反应而生成铜,铜离子反应后才可以和氢离子反应放出氢气,所以刚开始没有氢气产生,故D中生成氢气的反应速率不一定大于B,B错误;
C.B中稀硫酸和锌反应生成H2,压强增加,在A和B之间增设了导管a,其作用是平衡A和B内气压,使稀硫酸顺利流下,C正确;
D.根据分析可知G中生成的O2进入H中和过量H2S溶液反应,生成淡黄色的沉淀,则发生了反应:2H2S+ O2=2S↓+2H2O,此反应中O2为氧化剂,S为氧化产物,根据氧化还原反应强弱规律,氧化性:氧化剂>氧化产物,即氧化性:故O2>S,根据单质的氧化性越强,元素的非金属性越强,所以非金属性O>S,D正确。
答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO 部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、
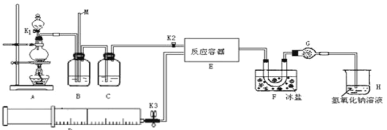
试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式__________。
(2)装置B的作用是 ①__________,②____________。
(3)若用A装置制取NO气体,B中应该盛放_________。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为___。
(5) 简述检查A、B、C所组成的实验装置气密性的操作_________。
(6)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与________________同时通入NaOH溶液中。
(7)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明 HNO2是弱酸:____________。(仅提供的试剂:1 molL-1HCl、 1 molL-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0 g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,用0.20 molL-1 AgNO3标准溶液滴定至终点,根据表中所给信息,应选用____________做指示剂,滴定终点的现象是______。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3 ×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为________。
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D