题目内容
17.(1)常温时,0.1mo1/L氨水在水中有0.1%发生电离,完成以下内容:①该溶液的pH=10;升高温度,溶液的pH升高(填“升高”、“降低”或“不变”).
②求该碱的电离平衡常数.(写出计算过程)
(2)0.1mo1/L NH4Cl溶液中,其电荷守恒关系式为:c(NH4+)+c(H+)=c(Cl-)+c(OH-);物料守恒关系式为:c(NH4+)+c(NH3•H2O)=c(Cl-)=0.1mo1/L.
(3)将0.1mo1/L的氨水和0.1mo1/L NH4Cl等体积混合,形成碱性溶液,溶液中NH3•H2O、NH4+、Cl-、H+、OH-的浓度由大到小的顺序为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+).
(4)在Mg(OH)2中加入浓NH4Cl溶液,Mg(OH)2溶解,无明显的气泡,写出离子反应方程式Mg(OH)2+2NH4+=Mg2++2NH3•H2O.
分析 (1)①NH3•H2O电离出的c(OH-)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg($\frac{1{0}^{-14}}{1{0}^{-4}}$)=10;升高温度,平衡右移,pH升高;
②由NH3•H2O?NH4++OH-,c(NH4+)=c(OH-)=10-4mol/L,则电离平衡常数为Kb=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7;
(2)0.1mo1/L NH4Cl溶液中,NH4+反应水解,据此写出守恒关系;
(3)将0.1mo1/L的氨水和0.1mo1/L NH4Cl等体积混合,形成碱性溶液,氨水的电离程度大于铵根离子的水解程度;
(4)在Mg(OH)2中加入浓NH4Cl溶液,Mg(OH)2溶解,无明显的气泡,生成的是氨水.
解答 解:(1)①NH3•H2O电离出的c(OH-)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg($\frac{1{0}^{-14}}{1{0}^{-4}}$)=10;升高温度,平衡右移,pH升高;
故答案为:10;升高;
②由NH3•H2O?NH4++OH-,c(NH4+)=c(OH-)=10-4mol/L,则电离平衡常数为Kb=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7;
故答案为:1×10-7;
(2)0.1mo1/L NH4Cl溶液中,NH4+反应水解,其电荷守恒关系式为c(NH4+)+c(H+)=c(Cl-)+c(OH-);物料守恒关系式为c(NH4+)+c(NH3•H2O)=c(Cl-)=0.1mo1/L;
故答案为:c(NH4+)+c(H+)=c(Cl-)+c(OH-);c(NH4+)+c(NH3•H2O)=c(Cl-)=0.1mo1/L;
(3)将0.1mo1/L的氨水和0.1mo1/L NH4Cl等体积混合,形成碱性溶液,氨水的电离程度大于铵根离子的水解程度,c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+);
故答案为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+);
(4)在Mg(OH)2中加入浓NH4Cl溶液,Mg(OH)2溶解,无明显的气泡,生成的是氨水,离子方程式为Mg(OH)2+2NH4+=Mg2++2NH3•H2O;
故答案为:Mg(OH)2+2NH4+=Mg2++2NH3•H2O.
点评 本题考查弱酸的电离,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答,难度不大.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案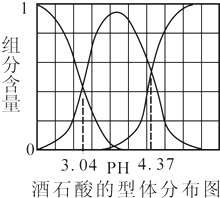
| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小 | |
| B. | H2A溶液在不同pH环境中各微粒的分布不同,电离平衡常数也不同 | |
| C. | 溶液的pH=4.5时,存在如下关系:C(Na+)>C(HA-)>C(A2-)>C(H+)>C(OH-) | |
| D. | 已知HClO的电离平衡常数为10-7.5将少量H2A 的溶液加入足量NaClO溶液中,发生的反应为:H2A+ClO-═HClO+HA- |
| A. | 乙酸的最简式:CH2O | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 苯的结构式:C6H6 | D. | 四溴化碳的电子式: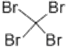 |
| A. | NaOH | B. | HCl | C. | KCl | D. | Na2SO4 |
| A. | 水果和蔬菜 | B. | 鱼肉和猪肉 | C. | 鸡蛋和鸭蛋 | D. | 糙米和肝脏 |
| A. | 氢氧化钡溶液与盐酸反应:OH-+H+=H2O | |
| B. | 向 FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| C. | 小苏打溶液与烧碱溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 氯气通入冷水中:Cl2+H2O=Cl-+ClO-+2H+ |