题目内容
7.某浓度的二元弱酸酒石酸溶液的型体分布图如图,将酒石酸简写成H2A,下列有关叙述正确的是( )
| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小 | |
| B. | H2A溶液在不同pH环境中各微粒的分布不同,电离平衡常数也不同 | |
| C. | 溶液的pH=4.5时,存在如下关系:C(Na+)>C(HA-)>C(A2-)>C(H+)>C(OH-) | |
| D. | 已知HClO的电离平衡常数为10-7.5将少量H2A 的溶液加入足量NaClO溶液中,发生的反应为:H2A+ClO-═HClO+HA- |
分析 由图象可知当pH=3.04时,c(H2A)=c(HA-),则K1=$\frac{c(H{A}^{-})c({H}^{+})}{c({H}_{2}A)}$=10-3.04,当pH=4.37时,c(HA-)=c(A2-),说明HA-电离大于HA-、A2-水解程度,溶液呈酸性,可知K2=$\frac{c({A}^{2-})c({H}^{+})}{c(H{A}^{-})}$=10-4.37,可知酸性HA->HClO,以此解答该题.
解答 解:由图象可知当pH=3.04时,c(H2A)=c(HA-),则K1=$\frac{c(H{A}^{-})c({H}^{+})}{c({H}_{2}A)}$=10-3.04,当pH=4.37时,可知K2=$\frac{c({A}^{2-})c({H}^{+})}{c(H{A}^{-})}$=10-4.37,
A.等体积等浓度的NaOH溶液与H2A溶液混合后生成NaHA,溶液呈酸性,则抑制水的电离,故A正确;
B.温度不变,则电离常数不变,故B错误;
C.由K2=$\frac{c({A}^{2-})c({H}^{+})}{c(H{A}^{-})}$=10-4.37可知,溶液的PH=4.5时,$\frac{c({A}^{2-})}{c(H{A}^{-})}$=$\frac{1{0}^{-4.37}}{1{0}^{-4.5}}$>1,则c(A2-)>c(HA-),故C错误;
D.K2=$\frac{c({A}^{2-})c({H}^{+})}{c(H{A}^{-})}$=10-4.37,HClO的电离平衡常数为10-7.5,则酸性HA->HClO,所以将少量H2A 的溶液加入足量NaClO溶液中,发生的反应为:H2A+2ClO-═2HClO+A2-,故D错误.
故选A.
点评 本题考查弱电解质的电离及离子浓度大小的比较,为高频考点,侧重于学生的分析、计算能力的考查,明确稀释及图象的分析是解答本题的关键,答题时注意平衡常数的运用,题目难度不大.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | W的金属性是同主族元素中最强的 | |
| B. | X、Z形成的化合物为离子化合物 | |
| C. | X最高价氧化物对应的水化物的酸性小于Z的最高价氧化物对应的水化物 | |
| D. | 原子半径Y>Z,离子半径Y3+<Z2- |
| A. | 热稳定性:PH3>H2S>HBr>NH3 | |
| B. | 物质的熔点:石英>食盐>冰>汞 | |
| C. | 结合质子的能力:CO32->CH3COO->SO42- | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| A. | Z的氧化物与水反应可制得相应的含氧酸 | |
| B. | X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 | |
| C. | X、Y、W的原子半径依次减小,对应的离子半径依次增大 | |
| D. | Z的氢化物的热稳定性强于W的氢化物 |
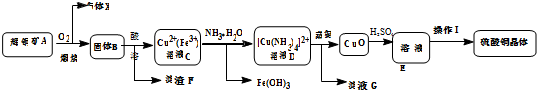
 工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动: