题目内容
6.下列离子方程式书写正确的是( )| A. | 氢氧化钡溶液与盐酸反应:OH-+H+=H2O | |
| B. | 向 FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| C. | 小苏打溶液与烧碱溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 氯气通入冷水中:Cl2+H2O=Cl-+ClO-+2H+ |
分析 A.氢氧化钡溶液与盐酸反应实质是氢离子与氢氧根离子的反应;
B.电荷不守恒;
C.小苏打溶液与烧碱溶液反应生成碳酸钠和水;
D.次氯酸为弱电解质,应保留化学式.
解答 解:A.氢氧化钡溶液与盐酸反应,离子方程式:OH-+H+=H2O,故A正确;
B.FeCl2溶液中通入Cl2,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故B错误;
C.小苏打溶液与烧碱溶液反应,离子方程式:HCO3-+OH-=CO32-+H2O,故C正确;
D.氯气通入冷水中,离子方程式:Cl2+H2O=Cl-+HClO-+H+,故D错误;
故选:AC.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分、原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
16.电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多1,Z的单质是一种半导体材料,常用于制造太阳能电池,W的原子半径是同周期中最小的.下列推断中正确的是( )
| A. | Z的氧化物与水反应可制得相应的含氧酸 | |
| B. | X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 | |
| C. | X、Y、W的原子半径依次减小,对应的离子半径依次增大 | |
| D. | Z的氢化物的热稳定性强于W的氢化物 |
14.下列防止金属腐蚀的做法可行的是( )
| A. | 在某些工具的机械转动部位刷油漆以防锈 | |
| B. | 衣架和电线外面包上一层塑料层以防锈 | |
| C. | 在钢材制造的大型船舶上装上一定数量的锌块 | |
| D. | 自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨 |
1.向含有1mol明矾的溶液中逐滴加入Ba(OH)2溶液,充分反应,下列说法不正确的是( )
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)2 1.5 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5 mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
18.有关金属腐蚀的下述说法,不恰当的是( )
| A. | 一般来说,金属越活泼,越易发生腐蚀 | |
| B. | 金属发生腐蚀时表现了明显的氧化性 | |
| C. | 气温越高,金属越易腐蚀 | |
| D. | 金属腐蚀通常分化学腐蚀和电化学腐蚀两类 |
15.一定条件下,电解较稀浓度的硫酸,H2O2仅为还原产物,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2$\frac{\underline{\;电解\;}}{\;}$O3+3H2O2.下列有关说法正确的是( )
| A. | 电解池的阳极生成双氧水,阴极生成臭氧 | |
| B. | 电解池中硫酸溶液的pH保持不变 | |
| C. | 产生臭氧的电极反应式为3H2O-6e-=O3+6H+ | |
| D. | 产生双氧水的电极反应式为2H2O-2e-=H2O2+2H+ |
16.“固体离子导体”是因为离子能在固体中迁移传递电荷.如图,空气中的O2与AlI3在聚四氟乙烯膜中反应生成I2,I2与Ag形成原电池,在RbAg4I5晶体中迁移的离子全是Ag+.下列说法中错误的是( )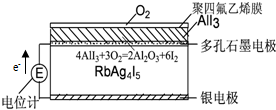

| A. | 电子从银电极在RbAg4I5晶体中迁移流向石墨电极 | |
| B. | Ag+从下往上移动 | |
| C. | 石墨电极为正极,银电极为负极 | |
| D. | 银电极的电极反应是:Ag-e-=Ag+ |
