题目内容
7.(1)某学生用KMnO4制备氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
当有15.8g KMnO4参加反应时,消耗0.8molHCl,其中被氧化的HCl有0.5 mol,有0.5mol电子转移,标准状况下生成Cl2的体积为5.6L.
(2)生成的氯气缓慢通入KI-淀粉溶液中,出现蓝色,离子方程式为Cl2+2I-=I2+2Cl-,若氯气用量(物质的量)达到KI的3倍时,蓝色完全消失,已知此时生成物中含碘物质只有一种,那么该物质中碘的化合价为+5.
分析 (1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,以此来解答.
(2)氯气具有氧化性能氧化碘离子为碘单质,碘单质遇淀粉变蓝,当氯气用量(物质的量)达到KI的3倍时单质碘又被氧化为碘酸钾.
解答 解:(1)n(KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,根据方程式可知反应消耗的HCl为0.8mol,反应中得到电子为0.1mol×5=0.5mol,则被氧化的还原剂HCl为0.5mol,转移电子数目为0.5mol,生成氯气为0.25mol,其体积为0.25mol×22.4L/mol=5.6L,
故答案为:0.8;0.5;0.5;5.6;
(2)氯气具有氧化性通入碘化钾溶液中会氧化碘离子为碘单质,碘单质遇淀粉变蓝,反应的离子方程式为:Cl2+2I-=I2+2Cl-,当氯气过量时,氯气与碘单质反应生成碘酸钾,碘酸钾中I的化合价为+5价;
故答案为:Cl2+2I-=I2+2Cl-;+5.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
18.有关金属腐蚀的下述说法,不恰当的是( )
| A. | 一般来说,金属越活泼,越易发生腐蚀 | |
| B. | 金属发生腐蚀时表现了明显的氧化性 | |
| C. | 气温越高,金属越易腐蚀 | |
| D. | 金属腐蚀通常分化学腐蚀和电化学腐蚀两类 |
15.一定条件下,电解较稀浓度的硫酸,H2O2仅为还原产物,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2$\frac{\underline{\;电解\;}}{\;}$O3+3H2O2.下列有关说法正确的是( )
| A. | 电解池的阳极生成双氧水,阴极生成臭氧 | |
| B. | 电解池中硫酸溶液的pH保持不变 | |
| C. | 产生臭氧的电极反应式为3H2O-6e-=O3+6H+ | |
| D. | 产生双氧水的电极反应式为2H2O-2e-=H2O2+2H+ |
12.下列物质中,同时含有氯分子、氯离子的是( )
| A. | 氯水 | B. | 液氯 | C. | 漂白粉 | D. | 氯化镁 |
19.碱金属的阳离子( )
| A. | 是强还原剂 | B. | 只有氧化性 | ||
| C. | 易被氧化 | D. | 其火焰都能呈现不同颜色 |
16.“固体离子导体”是因为离子能在固体中迁移传递电荷.如图,空气中的O2与AlI3在聚四氟乙烯膜中反应生成I2,I2与Ag形成原电池,在RbAg4I5晶体中迁移的离子全是Ag+.下列说法中错误的是( )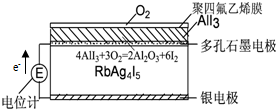

| A. | 电子从银电极在RbAg4I5晶体中迁移流向石墨电极 | |
| B. | Ag+从下往上移动 | |
| C. | 石墨电极为正极,银电极为负极 | |
| D. | 银电极的电极反应是:Ag-e-=Ag+ |
19.Se是人体必需微量元素,下列有关3478Se和3480Se的说法正确的是( )
| A. | 3478Se和3480Se 分别含有44和46个质子 | |
| B. | 3478Se和3480Se互为同位素 | |
| C. | 3478Se 和3480Se互为同素异形体 | |
| D. | 3478Se和3480Se都含有34个中子 |
 ,过氧化氢
,过氧化氢