题目内容
5.维生素C的结构简式如图所示.下列有关说法正确的是:( )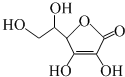
| A. | 维生素C所含的官能团有羟基、羧基、碳碳双键 | |
| B. | 维生素C能和溴水、酸性重铬酸钾溶液反应 | |
| C. | 维生素C的分子式为C6H6O6 | |
| D. | 维生素C能发生加成反应、氧化反应,不能发生取代反应 |
分析 该有机物中含有醇羟基、酯基、碳碳双键,具有醇、烯烃和酯的性质,能发生氧化反应、取代反应、酯化反应、加成反应、加聚反应、水解反应等,据此分析解答.
解答 解:A.维生素C所含的官能团有羟基、酯基、碳碳双键,故A错误;
B.含有碳碳双键,所以能和溴发生加成反应、能被酸性重铬酸钾溶液氧化,故B正确;
C.维生素C的分子式为C6H8O6,故C错误;
D.该分子中含有醇羟基、酯基,能发生取代反应,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃、醇、酯的性质,注意分子式的确定,为易错点.

练习册系列答案
相关题目
15.2012年6月25日俄罗斯媒体报道,杜布纳联合核研究所再次成功用${\;}_{20}^{48}$Ca轰击${\;}_{97}^{249}$Bk原子合成了质量数为293的117号新元素.117号元素位于元素周期表第七周期ⅦA族.下列有关叙述正确的是( )
| A. | 质量数为293的117号元素原子中质子数比中子数多176 | |
| B. | 117号元素是非金属元素 | |
| C. | ${\;}_{20}^{48}$Ca、${\;}_{20}^{40}$Ca 互称同位素 | |
| D. | 预测${\;}_{117}^{293}$X、${\;}_{117}^{294}$X 性质相同(用X表示117号元素的符号) |
16.利用铜萃取剂M,通过如图甲所示反应实现铜离子的富集:
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)M所含元素的电负性由大到小顺序为O>N>C>H,分子中碳原子的杂化方式有sp2、sp3.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图乙)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(5)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
(6)某Y原子的价电子排布式是3s23p5,铜与Y形成的化合物的晶胞结构如图丙;
①晶体的化学式是CuCl.
②已知该晶体的密度为ρg•cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子与Y原子之间的最短距离为=$\frac{\sqrt{3}}{4}\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).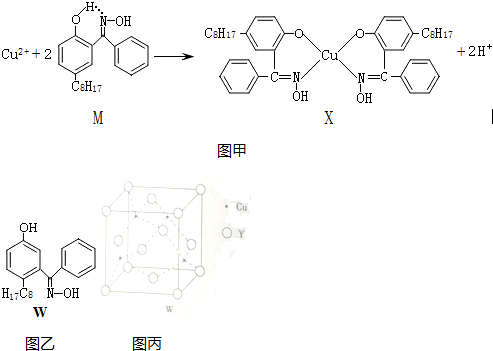
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)M所含元素的电负性由大到小顺序为O>N>C>H,分子中碳原子的杂化方式有sp2、sp3.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图乙)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(5)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
①晶体的化学式是CuCl.
②已知该晶体的密度为ρg•cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子与Y原子之间的最短距离为=$\frac{\sqrt{3}}{4}\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).

13.同分异构现象是造成有机物种类繁多的重要原因之一.下列各组物质中互为同分异构体的是( )
| A. | H与D | B. | CH3CH2OH与CH3COOH | ||
| C. | CH≡CH与C6H6 | D. | CH3CH2CH2CH3与 |
10.某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀不含CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:CuS存在溶解平衡CuS(s)?Cu2+(aq)+S2-(aq),热的浓硫酸将S2-氧化,使S2-浓度减小,促进上述平衡向正向移动,使CuS溶解.
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀不含CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O=BaSO4↓+NO+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
15.X、Y、Z、W、Q是原子充数依次增大的前四周期元素,X的基态原子s电子总数是p电子总数的2倍;Z是地壳中含量最多的元素;W、Q同周期,且最外层电子数都为1,Q的核外电子排布中未成对电子数为6.下列说法错误的是( )
| A. | X、Y、Z的气态氢化物的稳定性依次增强 | |
| B. | XZ2分子中δ键与π键个数之比为1:1 | |
| C. | 原子半径由大到小的顺序:W>Z>Y | |
| D. | 由Z、W、Q三种元素形成的某种化合物可用于检查司机是否酒后驾车 |
 青霉素是最重要的抗生索.青霉素在人体内经酸性水解后.得到青霉素氨基酸,其结构筒式如图所示.
青霉素是最重要的抗生索.青霉素在人体内经酸性水解后.得到青霉素氨基酸,其结构筒式如图所示. X、Y、Z、W是元素周期表中短周期元素,且原子序数依次递增,四种元素在元素周期表中的位置关系如图.四种元素的最高价含氧酸根离子一定能够水解的是( )
X、Y、Z、W是元素周期表中短周期元素,且原子序数依次递增,四种元素在元素周期表中的位置关系如图.四种元素的最高价含氧酸根离子一定能够水解的是( )