题目内容
15.X、Y、Z、W、Q是原子充数依次增大的前四周期元素,X的基态原子s电子总数是p电子总数的2倍;Z是地壳中含量最多的元素;W、Q同周期,且最外层电子数都为1,Q的核外电子排布中未成对电子数为6.下列说法错误的是( )| A. | X、Y、Z的气态氢化物的稳定性依次增强 | |
| B. | XZ2分子中δ键与π键个数之比为1:1 | |
| C. | 原子半径由大到小的顺序:W>Z>Y | |
| D. | 由Z、W、Q三种元素形成的某种化合物可用于检查司机是否酒后驾车 |
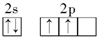
分析 X、Y、Z、W、Q是原子充数依次增大的前四周期元素,X的基态原子s电子总数是p电子总数的2倍,原子核外电子排布为1s22s22p2,故X为C元素;Z是地壳中含量最多的元素,则Z为O元素;Y原子序数介于碳、氧之间,故Y为N元素;W、Q同周期,且最外层电子数都为1,只能处于第四周期,Q的核外电子排布中未成对电子数为6,外围电子排布为3d54s1,故Q为Cr,W原子序数小于Cr,故W为K,据此解答.
解答 解:X、Y、Z、W、Q是原子充数依次增大的前四周期元素,X的基态原子s电子总数是p电子总数的2倍,原子核外电子排布为1s22s22p2,故X为C元素;Z是地壳中含量最多的元素,则Z为O元素;Y原子序数介于碳、氧之间,故Y为N元素;W、Q同周期,且最外层电子数都为1,只能处于第四周期,Q的核外电子排布中未成对电子数为6,外围电子排布为3d54s1,故Q为Cr,W原子序数小于Cr,故W为K.
A.X、Y、Z分别为C、N、O,非金属性依次增强,故气态氢化物的稳定性依次增强,故A正确;
B.XZ2分子为CO2,结构式为O=C=O,分子中δ键与π键个数之比为1:1,故B正确;
C.同周期自左而右原子半径较小、同主族自上而下原子半径增大,故原子半径由大到小的顺序:K>N>O,故C错误;
D.由Z、W、Q三种元素形成的化合物K2Cr2O4可用于检查司机是否酒后驾车,故D正确,
故选:C.
点评 本题结构性质位置关系综合应用,涉及核外电子排布、元素周期律、化学键等,根据核外电子排布规律推断元素是解题关键,难度中等.

练习册系列答案
相关题目
5.维生素C的结构简式如图所示.下列有关说法正确的是:( )
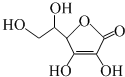

| A. | 维生素C所含的官能团有羟基、羧基、碳碳双键 | |
| B. | 维生素C能和溴水、酸性重铬酸钾溶液反应 | |
| C. | 维生素C的分子式为C6H6O6 | |
| D. | 维生素C能发生加成反应、氧化反应,不能发生取代反应 |
6.X、Y、Z、R、W是短周期主族元素,X原子的最外层电子数是其次外层的2倍,Y是地壳中含量最高的元素,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和,W与Y属于同一主族.下列叙述正确的是( )
| A. | Y、Z、R元素简单离子的半径依次增大 | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素W和R最高价氧化物对应水化物的酸性后者强 | |
| D. | Y与Z形成的两种化合物中的化学键类型和阴阳离子个数比均相同 |
20.下列除杂操作正确的是( )
| 物质 | 杂质 | 试剂 | 提纯方法 | |
| A | 苯 | 苯酚 | 溴水 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀氢氧化钠溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 蔗糖 | 饱和硫酸铵溶液 | 盐析、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
7.C4H9-O-C4H9丁醚的结构有( )种.
| A. | 8 | B. | 16 | C. | 10 | D. | 12 |
4.下列物质中,不是有机物的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 二硫化碳 | D. | 乙醇 |
 b.
b.
 ,化学式为C8H8O2的有机物有如下的转化关系:
,化学式为C8H8O2的有机物有如下的转化关系: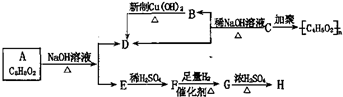
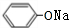 ,BCH3CHO.
,BCH3CHO.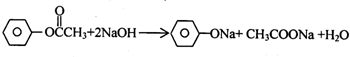 .
.