题目内容
15.2012年6月25日俄罗斯媒体报道,杜布纳联合核研究所再次成功用${\;}_{20}^{48}$Ca轰击${\;}_{97}^{249}$Bk原子合成了质量数为293的117号新元素.117号元素位于元素周期表第七周期ⅦA族.下列有关叙述正确的是( )| A. | 质量数为293的117号元素原子中质子数比中子数多176 | |
| B. | 117号元素是非金属元素 | |
| C. | ${\;}_{20}^{48}$Ca、${\;}_{20}^{40}$Ca 互称同位素 | |
| D. | 预测${\;}_{117}^{293}$X、${\;}_{117}^{294}$X 性质相同(用X表示117号元素的符号) |
分析 A.根据中子数=质量数-质子数计算比较;
B.117号元素为第七周期ⅤⅡA族元素,为金属元素;
C.同位素为质子数相同中子数不同的原子;
D.${\;}_{117}^{293}$X、${\;}_{117}^{294}$X质子数相同中子数不同,所以物理性质不相同;
解答 解:A.质量数为293的117号元素原子中质子数为117,中子数为293-117=176,所以质子数比中子数多176-117=59,故A错误;
B.117号元素为第七周期ⅤⅡA族元素,为金属元素,故B错误;
C.同位素为质子数相同中子数不同的原子,所以${\;}_{20}^{48}$Ca、${\;}_{20}^{40}$Ca 互称同位素,故C正确;
D.${\;}_{117}^{293}$X、${\;}_{117}^{294}$X质子数相同中子数不同,所以物理性质不相同,故D错误;
故选C.
点评 本题考查了原子结构,明确原子核外电子排布及基本概念即可解答,难度不大.

练习册系列答案
相关题目
6.下列有关实验的叙述正确的是( )
| A. | 将一定量的氯气通入30 mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系,n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 | |
| B. | 实验室可以配制一种仅含Al3+、K+、SO42-、NO3-这4种离子(不考虑来源于水电离的离子)的溶液,且4种离子的浓度均为1mol/L | |
| C. | HCl、FeCl3、Fe3O4、NaOH都可通过置换反应一步得到也可通过化合反应一步得到 | |
| D. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
3.能源是现代化社会生活的物质基础.背景材料:①2006年国际油价飙升,新型纳米金属燃料面世;②2005、2006年全国许多省市全面推广使用乙醇汽油;③2010年,江苏省打造成全国重要的太阳能产业基地;④生物柴油是以油脂为原料,通过水解、酯化得高级脂肪酸甲酯(含C、H、O元素).下列说法正确的是( )
| A. | 乙醇汽油推广的最主要的目的在于降低国际市场的油料价格 | |
| B. | 生物柴油燃烧不会产生二氧化碳,是一种清洁能源 | |
| C. | 太阳能是一种清洁安全的不可再生能源 | |
| D. | 纳米金属燃料表面积大,易引发,能量释放快 |
20.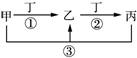 甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系见图,下列说法正确的是( )
甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系见图,下列说法正确的是( )
 甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系见图,下列说法正确的是( )
甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系见图,下列说法正确的是( )| A. | 若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3 | |
| B. | 若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O | |
| C. | 若甲、乙、丙的溶液显碱性,则丙可能可以作为医疗上治疗胃酸过多症的药剂 | |
| D. | 若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐 |
4.短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,金属铝能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| X | Y | |
| W | Q |
| A. | Y的最高化合价为+6 | B. | 简单离子的半径:W>Q>Y>X | ||
| C. | 氢化物的稳定性:W>Y | D. | 最高价氧化物的水化物的酸性:W<Q |
5.维生素C的结构简式如图所示.下列有关说法正确的是:( )
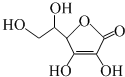

| A. | 维生素C所含的官能团有羟基、羧基、碳碳双键 | |
| B. | 维生素C能和溴水、酸性重铬酸钾溶液反应 | |
| C. | 维生素C的分子式为C6H6O6 | |
| D. | 维生素C能发生加成反应、氧化反应,不能发生取代反应 |
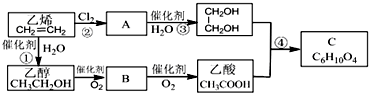
 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.根据图示转化关系回答:
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.根据图示转化关系回答: .
.