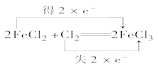题目内容
【题目】工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,2SO2(g)+O2(g)![]() 2SO3(g) △H= -197 kJ/mol。开始时在10 L的密闭容器中加入4.0 molSO2(g)和10.0 molO2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=_________,升高温度K将_____________(增大、减小或不变)。
2SO3(g) △H= -197 kJ/mol。开始时在10 L的密闭容器中加入4.0 molSO2(g)和10.0 molO2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=_________,升高温度K将_____________(增大、减小或不变)。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是__________________(填字母)。
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是__________________(填字母)。
A.恒温恒容,充入2mol SO3 B.恒温恒容,充入2mol N2
C.恒温恒压,充入1 mol SO3 D.升高温度
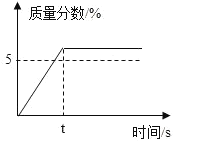
(3)在一密闭容器中进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 ____________(填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 ____________(填字母)。

A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且乙的温度较低
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
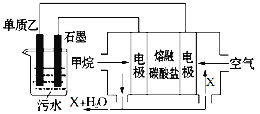
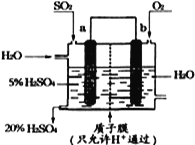
(4)某实验小组设想如右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:___________。
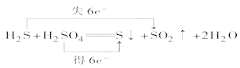
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:① 2SO2(g)+O2(g)![]() 2SO3(g)△H1= —197 kJ/mol;② H2O(g)=H2O(l)△H2= —44 kJ/mol;③ 2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3= —545 kJ/mol。写出SO3(g)与H2O(l)反应的热化学方程式是_____________________________。
2SO3(g)△H1= —197 kJ/mol;② H2O(g)=H2O(l)△H2= —44 kJ/mol;③ 2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3= —545 kJ/mol。写出SO3(g)与H2O(l)反应的热化学方程式是_____________________________。
(6)由硫酸可制得硫酸盐,在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,SO42-和CO32-的浓度之比___________________________。 (已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)= 5.2×10-9。)
【答案】(1)10/9 (2分) 减小(2分)
(2)A(2分)
(3)CD(2分)
(4)SO2+2H2O-2e-=SO42-+4H+(2分)
(5)SO3(g) + H2O(1)![]() H2SO4(l) △H1= -130kJ/mol;(3分)
H2SO4(l) △H1= -130kJ/mol;(3分)
(6)1:40(2分)
【解析】
试题(1)反应达到平衡时共放出197kJ的热量,根据热化学方程式可知反应了2.0mol SO2和1.0mol O2,
根据三段式进行计算: 2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始浓度(molL1) 0.4 1 0
转化浓度(molL1) 0.2 0.1 0.2
平衡浓度(molL1) 0.2 0.9 0.2
该温度下的平衡常数K= 0.22÷(0.22×0.9)=10/9;因为该反应为放热反应,升高温度,平衡向左移动,所以K将减小。
(2)A、保持温度和容器体积不变,充入2mol SO3,平衡向逆反应分析移动,则SO2、O2、SO3气体平衡浓度都比原来增大,正确;B、保持温度和容器体积不变,充入2mol N2,对平衡移动没有影响,各物质的浓度不变,错误;C、保持温度和容器内压强不变,充入1mol SO3,处于等效平衡状态,浓度不变,错误;D、升高温度,平衡向逆反应分析移动,SO3的浓度减小,错误。
(3)A、催化剂不影响平衡,SO3的浓度相等,与图像不符合,错误;B、甲的反应速率快,所以甲的压强大,平衡向右移动,SO2的转化率大,与图像不符合,错误;C、甲的反应速率快,所以甲的温度高,平衡向左移动,SO2的转化率小,与图像符合,正确;D、催化剂加快反应速率,不影响平衡,与图像符合,正确。
(4)依据图中所示装置,二氧化硫失电子发生氧化反应,在水溶液中转化为硫酸;电极反应为:SO2+2H2O-2e-=SO42-+4H+。
(5)首先写出SO3与水反应的化学方程式并注明状态,然后根据盖斯定律求出反应热,H=-1/2H1-H2+1/2H3=-130kJmol1,即可写出热化学方程式。
(6)c(SO42):c(CO32)=Ksp(BaSO4)/c(Ba2+):Ksp(BaCO3)/c(Ba2+)=Ksp(BaSO4)/Ksp(BaCO3)=1:40

【题目】今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)根据第②个实验可以确定存在的离子是_______;
(2)除(1)中确定存在的离子以外,还一定存在的离子是__________,可能存在的离子是______;
(3)第③个实验中沉淀减少的原因是(用离子方程式表示)______________。
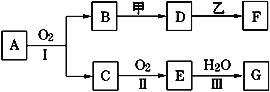
【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是

选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D