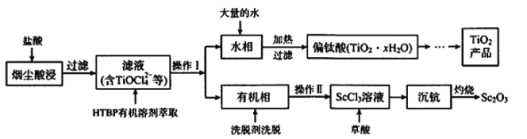
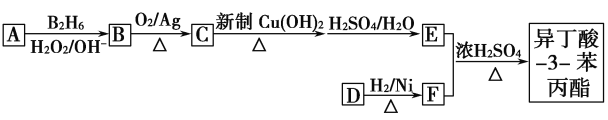
题目内容
【题目】配制50g质量分数5%的KNO3溶液,溶解过程KNO3的质量分数随时间变化关系如图所示,观察图象,分析形成这种结果的原因是
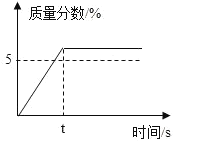
A.所用KNO3固体中含有水分B.量筒量水时俯视刻度线
C.KNO3固体溶解前所用烧杯内有水D.配好的溶液装瓶时部分液体洒落在试剂瓶外
【答案】B
【解析】
A. 所用KNO3固体中含有水分,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,A项错误;
B. 量简量水时俯视刻度线,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,B项正确;
C.KNO3固体溶解前所用烧杯内有水,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,C项错误;
D. 配好的溶液装瓶时部分液体洒落在试剂瓶外,溶液具有均一性,溶质质量分数不变,D项错误;
答案选B。

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
【题目】下列根据实验操作和实验现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
B | 将Na2SO3样品溶于水,滴加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 原Na2SO3样品已变质 |
C | 向淀粉KI溶液中滴入3滴稀硫酸,再加入10%的H2O2溶液 | 滴入稀硫酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
D | 向5mL0.5mol/LNaHCO3溶液中滴入2mL1mol/LBaCl2溶液 | 产生白色沉淀,且有无色气体生成 | 反应的化学方程式为2NaHCO3+BaCl2=BaCO3↓+ 2NaCl+CO2↑+H2O |
A. AB. BC. CD. D