题目内容
在55℃时,下列说法正确的是
| A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 |
| B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L |
| C.饱和氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) |
| D.0.1mol/L的(NH4)2SO4溶液中:c(NH4+) > c(SO42-) > c(H+) > c(OH-) |
D
解析试题分析:A. NaHSO4=Na++H++SO42-,电离出H+的抑制了水的电离,c(H+)增大,Kw不变,错误;B.审题“在55℃时”,水的离子积不是1×10-14,计算所得的c(OH-)不是1×10-6mol/L,错误;C.饱和氯水中,溶解进入水中的氯气并没有全部和水反应,此项中的关系式不对,错误;D.强酸弱碱盐,显酸性,故c(H+) > c(OH-),根据(NH4)2SO4=2NH4++SO42-,水解在这里是微弱的,所以c(NH4+) > c(SO42-),而c(SO42-) > c(H+),正确。
考点: 水的电离及影响因素、PH值的计算、盐类的水解及离子浓度的大小、氯水中的离子成分及浓度的大小。

25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是
| A.c(OH-) | B.pH | C.c(NH4+)/c(NH3·H2O) | D.c(H+)·c(OH-) |
消毒液在日常生活中被广泛应用。某消毒液无色,pH>7,对某些有色物质有漂白作用。你认为它可能的有效成分是
| A.NaCl | B.Na2CO3 | C.KMnO4 | D.NaClO |
0.lmol/L的K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.lmol/L。如果要使c(CO32-)更接近于0.lmol/L,可以采取的措施是( )
| A.加入少量盐酸 | B.加入适量的水 | C.加入适量的KOH | D.加热 |
由一价离子组成的四种盐AC、BD、AD、BC均为0.1 mol/L溶液,在同温下,前两种溶液pH=7,第三种溶液pH>7,最后一种溶液pH<7, 则形成四种盐的酸和碱强弱比较正确的是
| | A | B | C | D |
| 碱 性 | AOH>BOH | AOH>BOH | AOH<BOH | AOH<BOH |
| 酸 性 | HC<HD | HC>HD | HC>HD | HC< HD |
25 ℃时,2a mol·L-1次氯酸水溶液中,用NaOH溶液调节其pH(忽略溶液体积的变化),得到c(HClO)、c(ClO-)与溶液pH的变化关系如图所示。下列说法正确的是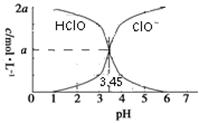
| A.当pH=2时,溶液中c(ClO-)>c(Na+) |
| B.当c(ClO-)>c(HClO)时,溶液一定呈碱性 |
| C.当pH=3.45时,所加NaOH溶液恰好与HClO完全反应 |
| D.当pH=5时,溶液中:c(HClO)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1 |
下列溶液中各离子的浓度关系不正确的是( )
| A.0.1 mol·L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 |
| B.浓度均为0.1 mol·L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中: c(CO 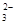 )+c(OH-)=c(H+)+c(H2CO3) )+c(OH-)=c(H+)+c(H2CO3) |
| C.25 ℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中: c(Na+>c(CN-)>c(HCN)>c(OH-) |
| D. 3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中: |
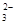 )>c(HCO
)>c(HCO )>c(OH-)>c(H+)
)>c(OH-)>c(H+) 常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是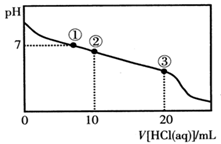
| A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH) |