题目内容
4.下列叙述中错误的是( )| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 用乙醇和3%的硫酸共热到170℃制取乙烯 |
分析 A.硝基取代苯环上的H原子生成硝基苯;
B.根据碳碳双键能发生加成反应,苯环也可发生加成反应;
C.含碳碳双键的物质与卤素单质能发生加成反应;
D.制取乙烯,应用浓硫酸.
解答 解:A.苯与浓硝酸、浓硫酸共热并保持50~60℃反应,硝基取代苯环上的H原子,生成硝基苯,故A正确;
B.碳碳双键能发生加成反应,苯环也可发生加成反应,所以苯乙烯在合适条件下催化加氢可生成乙基环己烷,故B正确;
C.碳碳双键能发生加成反应,所以乙烯和溴的四氯化碳溶液反应生成1,2-二溴乙烷,故C正确;
D.验室制乙烯用的是浓硫酸和乙醇反应,利用浓硫酸的脱水性和吸水性,使乙醇分子发生分子内脱水,所以用乙醇和3%的硫酸共热到170℃制取乙烯错误,故D错误;
故选:D.
点评 本题主要考查了常见有机物的性质及发生反应,明确物质的结构尤其是官能团是解题关键,注意有机反应发生的条件,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
12.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体.它的分子是三角锥形,以下关于PH3的叙述正确的是( )
| A. | PH3是非极性分子,难溶于水 | |
| B. | PH3的熔沸点高于NH3,极易被液化 | |
| C. | PH3稳定性弱于NH3,是因为NH3分子间还存在氢键 | |
| D. | PH3分子中有未成键的孤对电子 |
19.关于硝酸的说法正确的是( )
| A. | 浓硝酸见光或受热易分解,必须保存在棕色瓶中 | |
| B. | 浓HNO3是种强氧化剂,但只能使湿润蓝色的石蕊试纸显红色而不褪色 | |
| C. | 稀HNO3和活泼金属反应时主要得到氢气 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
9.苯分子中六个碳-碳键是完全等同的,不是单双键交替结构,下列事实可以作为证据的是( )
①苯不能使溴的CCl4溶液褪色;②苯不能使酸性高锰酸钾溶液褪色;③苯在一定条件下既能发生取代反应,又能发生加成反应;④经测定,邻二甲苯只有一种结构;⑤苯的一氯代物只有一种.
①苯不能使溴的CCl4溶液褪色;②苯不能使酸性高锰酸钾溶液褪色;③苯在一定条件下既能发生取代反应,又能发生加成反应;④经测定,邻二甲苯只有一种结构;⑤苯的一氯代物只有一种.
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①②④ | D. | ①②③④ |
16.下列排列顺序正确的是( )
| A. | 粒子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
13.含有一个-C≡C-的炔烃与氢气发生加成反应后的产物的结构简式如图所示,此炔烃可能的结构有( )
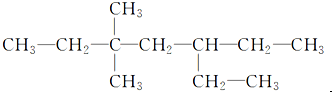
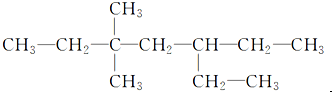
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
15.硫和硒(Se)、磷(Te)为同主族元素,在生产、生活中有着广泛用途.
Ⅰ、SO2、CO2转化利用是净化环境,造福人类的有效途径,一种用电化学原理,将SO2、CO2转化成用途广泛的化工产品H2SO4和CH3OH,其装置如图所示:

(1)该装置的工作原理是原电池;(填“原电池”或“电解池”)
(2)若A为CO2,B为H2,C为CH3OH,则通入H2-极为负;
(3)若A为SO2,B为O2,C为H2SO4,则A极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ、硒是地壳中稀有元素,工业上硒鼓废料(主要成分:硒、碲、碳、铜、铁合金)回收精炼硒的一种工艺流程如下:
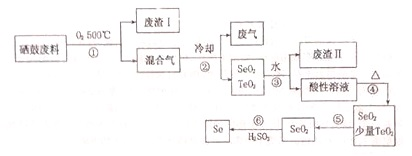
已知:
(1)硒的最高价氧化物对应水化合物化学式:H2SeO4;
(2)废气主要成分是CO2;
(3)步骤④的反应方程式:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O;步骤⑥的反应方程式:2H2SO3+SeO2=Se+2H2SO4;
(4)根据表中数据,步骤⑤中分离SeO2和TeO2的最佳方案是升华,将温度控制在315℃到450℃之间.
Ⅰ、SO2、CO2转化利用是净化环境,造福人类的有效途径,一种用电化学原理,将SO2、CO2转化成用途广泛的化工产品H2SO4和CH3OH,其装置如图所示:

(1)该装置的工作原理是原电池;(填“原电池”或“电解池”)
(2)若A为CO2,B为H2,C为CH3OH,则通入H2-极为负;
(3)若A为SO2,B为O2,C为H2SO4,则A极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ、硒是地壳中稀有元素,工业上硒鼓废料(主要成分:硒、碲、碳、铜、铁合金)回收精炼硒的一种工艺流程如下:

已知:
| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 易溶于水 |
(2)废气主要成分是CO2;
(3)步骤④的反应方程式:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O;步骤⑥的反应方程式:2H2SO3+SeO2=Se+2H2SO4;
(4)根据表中数据,步骤⑤中分离SeO2和TeO2的最佳方案是升华,将温度控制在315℃到450℃之间.
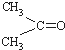 )与两个烃基相连的化合物叫酮(如丙酮 ).下列醇能发生脱氢氧化,但不可能得到醛类化合物的是( )
)与两个烃基相连的化合物叫酮(如丙酮 ).下列醇能发生脱氢氧化,但不可能得到醛类化合物的是( )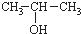
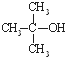
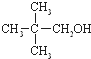
 回答下列问题:
回答下列问题: