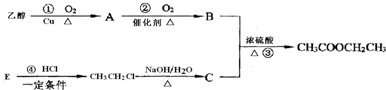
题目内容
2.已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离于浓度大小顺序有如下四种关系:①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是醋酸钠,上述四种离子浓度的大小顺序为①(填编号).
(2)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,则混合前两溶液的物质的量浓度大小关系为c(NaOH)等于c(CH3COOH)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+)小于c(OH-).
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好是中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)小于c(CH3COOH)(填“大于”“小于”或“等于”),混合后溶液中的各离子浓度的大小关系为c(CH3COO-)=c(Na+)>c(H+)=c(OH-).
分析 某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,溶质可能是氢氧化钠和醋酸钠、醋酸钠、醋酸钠和醋酸;
(1)若为CH3COONa溶液,由醋酸根离子水解来分析;
(2)该溶液是由体积相等的NaOH溶液和醋酸混合而成,且两者恰好中和,则醋酸与氢氧化钠的物质的量相等,反应生成的是醋酸钠溶液;醋酸为弱电解质,在溶液中只能部分电离,则反应前酸中c(H+)小于碱中c(OH-);
(3)要使混合溶液呈酸性,则醋酸的物质的量大于氢氧化钠;溶液恰好呈中性,则c(H+)=c(OH-),结合电荷守恒及盐的水解原理判断溶液中各离子浓度大小.
解答 解:某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,溶质可能是氢氧化钠和醋酸钠、醋酸钠、醋酸钠和醋酸;
(1)若为CH3COONa溶液,醋酸根离子水解、钠离子不水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-),醋酸根离子水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故选①,
故答案为:醋酸钠;①;
(2)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,则两溶液中醋酸和氢氧化钠的物质的量相等,两溶液体积相等,则醋酸和氢氧化钠溶液的浓度相等;由于醋酸为弱酸,氢氧化钠为强电解质,则混合前酸中c(H+)小于碱中c(OH-),
故答案为:等于;小于;
(3)要使混合溶液呈酸性,则醋酸的物质的量大于氢氧化钠,二者体积相等,则混合前两溶液的物质的量浓度大小关系为c(NaOH)<c(CH3COOH);溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知:c(CH3COO-)=c(Na+),则溶液中离子浓度大小为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),
故答案为:小于;c(CH3COO-)=c(Na+)>c(H+)=c(OH-).
点评 本题考查离子浓度的大小比较,题目难度中等,注意根据溶液离子浓度的关系结合弱电解质的电离和盐类的水解等知识解答,溶液中电荷守恒的应用.

 名校课堂系列答案
名校课堂系列答案| A. | 36:60 | B. | 60:36 | C. | 1:2 | D. | 1:3 |
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;Na、Mg、Al的第一电离能由大到小的顺序是Mg>Al>Na.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
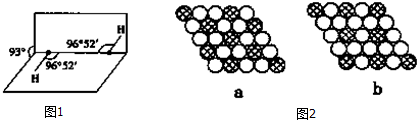
(5)如图1所示是H2O2的空间构型,H2O2分子中每个氧原子都是杂化,H2O2为极性 (填“极性”或“非极性”)分子.
(6)H2S和H2O2的主要物理性质如表所示:
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
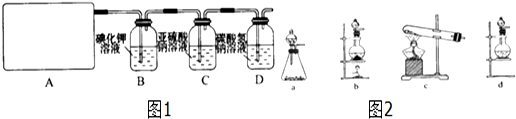
(7)如图2所示为二维平面晶体示意图,所表示的化学式为AX3的是b.
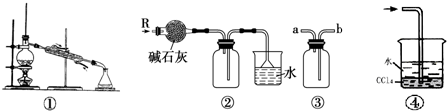
| A. | 装置①可用于由工业酒精制取无水酒精 | |
| B. | 装置②可用于干燥、收集氨气,并吸收多余的氨气 | |
| C. | 装置③可用于排空气法收集NO气体 | |
| D. | 装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
| A. | 常温常压下,23g NO2中含有NA个O原子 | |
| B. | 16g CH4中含有NA个C-H共价键 | |
| C. | 标准状态下,2.24L水中所含的分子数为0.1NA | |
| D. | 在0.1mol/L AlCl3溶液中所含的Cl- 的个数为0.3NA |
 .
. .
. 依据氧化还原反应:
依据氧化还原反应: