题目内容
19.形成物质世界多样性的原因有:①元素种类 ②同位素 ③化学键成键方式 ④同分异构体现象 ⑤同素异形体现象( )| A. | ①②③ | B. | ②④⑤ | C. | 仅①③ | D. | ①②③④⑤ |
分析 物质元素组成、同位素、化学键成键方式、同分异构现象、同素异形现象以及物质的状态等许多原因造成物质世界的多样性,据此解答.
解答 解:物质元素组成、同位素、化学键成键方式、同分异构现象、同素异形现象以及物质的状态等许多原因造成物质世界的多样性,
①元素种类多样性,不同的元素可以组成不同的物质,同一元素也可组成不同的物质;
②同位素的存在也是物质世界多样性的原因之一,同种元素可以有不同的核素,例如氢元素存在:11H、21H、31H三种同位素;
③成键方式的多样性也是物质世界多样性的原因之一,例如碳原子之间可以以单键、双键、三键的形式结合;
④同分异形现象的存在也是物质世界多样性的原因之一,相同的分子式,结构不同,可以代表不同的物质,例如C3H6O2,可以表示丙酸、甲酸乙酯、乙酸甲酯等;
⑤同素异形体现象的存在也是物质世界多样性的原因之一,同种元素可以组成不同种单质,例如氧气和臭氧,金刚石和石墨、足球烯;
故选:D.
点评 本题考查了物质世界多样性的原因,题目难度不大,注意从物质的构成、物质的类别和物质的组成元素去分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.物质结构决定性质,深入研究物质的微观结构,有利于理解物质变化的本质.请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;Na、Mg、Al的第一电离能由大到小的顺序是Mg>Al>Na.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
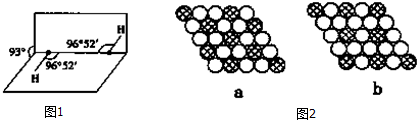
(5)如图1所示是H2O2的空间构型,H2O2分子中每个氧原子都是杂化,H2O2为极性 (填“极性”或“非极性”)分子.
(6)H2S和H2O2的主要物理性质如表所示:
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子之间会形成氢键,熔沸点高,H2O2与水分子之间会形成氢键,溶解度大.
(7)如图2所示为二维平面晶体示意图,所表示的化学式为AX3的是b.
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;Na、Mg、Al的第一电离能由大到小的顺序是Mg>Al>Na.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
(5)如图1所示是H2O2的空间构型,H2O2分子中每个氧原子都是杂化,H2O2为极性 (填“极性”或“非极性”)分子.

(6)H2S和H2O2的主要物理性质如表所示:
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(7)如图2所示为二维平面晶体示意图,所表示的化学式为AX3的是b.
4.用NA表示阿伏加德罗常数,N表示微粒数,下列说法正确的是( )
| A. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 1.6 g CH4含有共用电子对的数目为0.5NA | |
| D. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA |
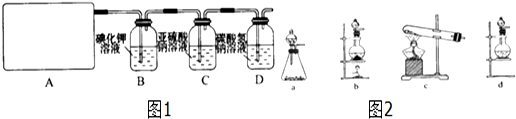
11.如图各装置不能达到实验目的是( )

| A. | 装置①可用于由工业酒精制取无水酒精 | |
| B. | 装置②可用于干燥、收集氨气,并吸收多余的氨气 | |
| C. | 装置③可用于排空气法收集NO气体 | |
| D. | 装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
8.在下列变化过程中,有发生化学变化的是( )
| A. | 荔枝酿酒 | B. | 酸雨侵蚀建筑物 | ||
| C. | 空气液化制取氮气 | D. | 生石灰遇水成为熟石灰 |
9.可逆反应4NH3(g)+5O2 (g)?4NO(g)+6H2O(g),下列叙述能说明反应已达平衡状态的是( )
| A. | 达到化学平衡时,υ正(NH3)=υ逆(H2O) | |
| B. | 达到化学平衡时,4υ (O2)=5υ (NO) | |
| C. | 若单位时间内生成x mol NO的同时,也消耗x mol NH3 | |
| D. | 若单位时间内生成4 mol NO的同时,也生成4 mol NH3 |
 依据氧化还原反应:
依据氧化还原反应: