题目内容
18.下列物质混合后,能发生离子反应的是( )| A. | 硫酸钠溶液和氯化钡溶液 | B. | 硝酸钠溶液与氯化钾溶液 | ||
| C. | 稀盐酸和碳酸钠溶液 | D. | 稀硫酸滴到铜片上 |
分析 根据离子之间能结合生成沉淀、气体、水等,则离子能发生反应,以此来解答.
解答 解:A.反应生成硫酸钡沉淀,可发生离子反应,故A选;
B.相互交换成分,不生成沉淀、气体、水等,则不发生离子反应,故B不选;
C.反应生成水、二氧化硫,可发生离子反应,故C选;
D.金属活动性顺序中Cu排在H之后,则Cu与稀硫酸不反应,故D不选;
故选AC.
点评 本题考查离子反应的条件,为高频考点,把握复分解反应的条件及金属活动性顺序的应用等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
13.工业上用碳还原SiO2制取单质硅会发生如下副反应:SiO2+3C═SiC+2CO↑.该反应中氧化剂与还原剂的质量比为( )
| A. | 36:60 | B. | 60:36 | C. | 1:2 | D. | 1:3 |
7.物质结构决定性质,深入研究物质的微观结构,有利于理解物质变化的本质.请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;Na、Mg、Al的第一电离能由大到小的顺序是Mg>Al>Na.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
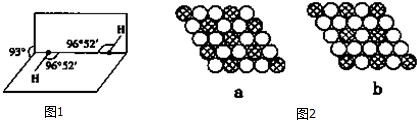
(5)如图1所示是H2O2的空间构型,H2O2分子中每个氧原子都是杂化,H2O2为极性 (填“极性”或“非极性”)分子.
(6)H2S和H2O2的主要物理性质如表所示:
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子之间会形成氢键,熔沸点高,H2O2与水分子之间会形成氢键,溶解度大.
(7)如图2所示为二维平面晶体示意图,所表示的化学式为AX3的是b.
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;Na、Mg、Al的第一电离能由大到小的顺序是Mg>Al>Na.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
(5)如图1所示是H2O2的空间构型,H2O2分子中每个氧原子都是杂化,H2O2为极性 (填“极性”或“非极性”)分子.

(6)H2S和H2O2的主要物理性质如表所示:
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(7)如图2所示为二维平面晶体示意图,所表示的化学式为AX3的是b.
8.在下列变化过程中,有发生化学变化的是( )
| A. | 荔枝酿酒 | B. | 酸雨侵蚀建筑物 | ||
| C. | 空气液化制取氮气 | D. | 生石灰遇水成为熟石灰 |
 依据氧化还原反应:
依据氧化还原反应: