题目内容
11.短周期主族元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为18.X原子半径比Y的小,Z是地壳中含量最高的元素,W与Z同主族.下列说法正确的是( )| A. | 原子半径由小到大的顺序为:rW<rZ<rY | |
| B. | 简单离子氢化物的热稳定性Z>Y | |
| C. | X2W的沸点高于X2Z | |
| D. | 只含X、Y、W三种元素的化合物,不可能是离子化合物 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最高的元素,则Z是O元素;W与Z同主族,则W是S元素;X原子半径比Y的小,且原子序数序数X<Y<O原子,故X只能处于第一周期,Y处于第二周期,则X为H元素,Y原子最外层电子数为18-1-6-6=5,故Y为N元素.
A.电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素非金属性越强,其氢化物越稳定;
C.水分子之间存在氢键;
D.只含H、N、S三种元素的化合物,可以形成(NH4)2S、NH4HS等.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最高的元素,则Z是O元素;W与Z同主族,则W是S元素;X原子半径比Y的小,且原子序数序数X<Y<O原子,故X只能处于第一周期,Y处于第二周期,则X为H元素,Y原子最外层电子数为18-1-6-6=5,故Y为N元素.
A.电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,故原子半径r(S)>r(N)>r(O),故A错误;
B.非金属性O>N,元素非金属性越强,其氢化物越稳定,故稳定性H2O>NH3,故B正确;
C.水分子之间存在氢键,沸点高于硫化氢,故C错误;
D.只含H、N、S三种元素的化合物,可以形成(NH4)2S、NH4HS,二者均属于离子化合物,故D错误,
故选B.
点评 本题考查位置结构性质关系综合应用,侧重考查元素周期律的运用,推断元素是解题关键,注意氢键对物质性质的影响,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
17.化学与生活、社会密切相关.下列有关说法正确的是( )
| A. | 在人体内酶的作用下,纤维素可以发生水解生成葡萄糖 | |
| B. | 福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜 | |
| C. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 |
2.已知反应:H2(g)+ICl(g)→HCl(g)+I2(未配平),当生产1molI2时△H=aKJ•mol-1.其反应历程如下:
①H2(g)+HCl=HClI(g)+H(g)(慢)
②H(g)+ICl(g)=HCl(g)+I(g)(快)
③HClI(g)=HCl(g)+I(g)(快)
④I(g)+I(g)=I2(g)(快)
下列有关该反应的说法正确的是( )
①H2(g)+HCl=HClI(g)+H(g)(慢)
②H(g)+ICl(g)=HCl(g)+I(g)(快)
③HClI(g)=HCl(g)+I(g)(快)
④I(g)+I(g)=I2(g)(快)
下列有关该反应的说法正确的是( )
| A. | 该反应的速率主要①决定 | B. | HClI是该反应的催化剂 | ||
| C. | v(H2)=v(HCl)=v(I2) | D. | a值越小,该反应速率越快 |
19.一定条件下,CO2分子晶体可转化为具有类似SiO2结构的原子晶体.从理论上分析,下列说法正确的是( )
| A. | 该转化过程是物理变化 | |
| B. | 1molCO2原子晶体中含2molC-O键 | |
| C. | CO2原子晶体的熔点高于SiO2 | |
| D. | CO2的原子晶体和分子晶体互为同分异构体 |
16.聚苯乙烯塑料在生产、生活中有广泛应用,其单体苯乙烯可由乙苯和二氧化碳在一定条件下发生如下反应制取:下列有关苯乙烯的说法正确的是( )
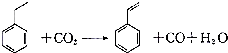

| A. | 分子中含有5个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
3.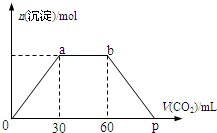 向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
 向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | 横坐标轴上p点的值为90 | |
| C. | b点时溶质为NaHCO3 | |
| D. | ab段发生反应的离子方程式依次为:CO2+2OH-→H2O+CO32-,CO2+H2O+CO32-→2HCO3- |
20.根据如表数据,则与HClO3比,HClO具有的是( )
| Cl-O键键长(pm) | Cl-O键能(KJ/mol) | |
| HClO | 170 | 209 |
| HClO3 | 157 | 244 |
| A. | 更高的沸点 | B. | 更强的酸性 | ||
| C. | Cl-O断裂放出的能量更少 | D. | 更易放出原子氧 |