题目内容
20.根据如表数据,则与HClO3比,HClO具有的是( )| Cl-O键键长(pm) | Cl-O键能(KJ/mol) | |
| HClO | 170 | 209 |
| HClO3 | 157 | 244 |
| A. | 更高的沸点 | B. | 更强的酸性 | ||
| C. | Cl-O断裂放出的能量更少 | D. | 更易放出原子氧 |
分析 A.分子晶体沸点与分子间作用力有关;
B.含氧酸酸性强弱取决于O-H键稳定性;
C.化学键断裂需要吸收能量;
D.共价键键长越长,键能越小,越不稳定,越容易断裂.
解答 解:A.HClO与HClO3,都是分子晶体,熔沸点高低取决于分子间作用力强弱,与化学键强弱无关,故A错误;
B.含氧酸酸性强弱取决于O-H键稳定性,与Cl-O无关,故B错误;
C.Cl-O断裂需要吸收热量,故C错误;
D.依据表中数据可知则与HClO3比,HClO中Cl-O,键长较长,键能较低,所以稳定性较差,更容易发生断裂,更易放出原子氧,故D正确;
故选:D.
点评 本题考查了化学键与物质性质的关系,明确分子晶体熔沸点规律,化学键键参数的意义是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列说法正确的是( )
| A. | 配制1.001.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| B. | 在50mL量筒中配制0.100 0moL•L-1碳酸钠溶液 | |
| C. | 只有100mL容量瓶、烧杯、玻璃棒、胶头滴管(非玻璃仪器任选),用pH=1的盐酸无法配制100mLpH=2的盐酸 | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
11.短周期主族元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为18.X原子半径比Y的小,Z是地壳中含量最高的元素,W与Z同主族.下列说法正确的是( )
| A. | 原子半径由小到大的顺序为:rW<rZ<rY | |
| B. | 简单离子氢化物的热稳定性Z>Y | |
| C. | X2W的沸点高于X2Z | |
| D. | 只含X、Y、W三种元素的化合物,不可能是离子化合物 |
8.下列离子方程式中,正确的是( )
| A. | 向AgCl悬浊液中加入KBr溶液:Ag++Br-=AgBr | |
| B. | 用铁棒作阴极、碳棒作阳极电解饱和氯化镁溶液:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O | |
| D. | 在强碱性溶液中NaClO与Fe(OH)3生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3═2FeO43-+3C1-+5H2O |
15.下列关于化学反应速率的说法中正确的是( )
| A. | 化学反应速率可用某时刻生成物的物质的量来表示 | |
| B. | 在同一反应中,用反应物或生成物表示的化学反应速率的值是相对的 | |
| C. | 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加 | |
| D. | 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率 |
12.下列化学用语使用正确是( )
| A. | 氧原子能量最高的电子的电子云图: | |
| B. | 35Cl与37Cl互为同素异形体 | |
| C. | CH4分子的比例模型: | |
| D. | 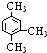 的命名:1,3,4-三甲苯 的命名:1,3,4-三甲苯 |
1.下列说法正确的是( )
| A. | 苯能使酸性KMnO4溶液褪色 | |
| B. | 甲醛与苯酚反应能形成高分子化合物 | |
| C. | 乙醇和苯酚都是电解质 | |
| D. | 将乙醇与浓硫酸共热产物直接通入KMnO4溶液中,以证明产物是乙烯 |
2.下列物质一定属于同系物的是( )
①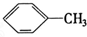 ②
②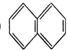 ③
③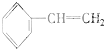 ④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦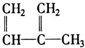 ⑧
⑧
①
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦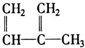 ⑧
⑧
| A. | ⑦和⑧ | B. | ⑤和⑦ | C. | ①、②和③ | D. | ④、⑥和⑧ |