题目内容
16.聚苯乙烯塑料在生产、生活中有广泛应用,其单体苯乙烯可由乙苯和二氧化碳在一定条件下发生如下反应制取:下列有关苯乙烯的说法正确的是( )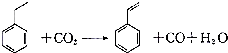
| A. | 分子中含有5个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
分析 苯乙烯中含有碳碳双键和苯环,具有苯、烯烃的性质,能发生加成反应、氧化反应、还原反应、加聚反应,据此分析解答.
解答 解:A.苯乙烯中只有乙烯基含有碳碳双键,苯不含碳碳双键,则分子中含有一个碳碳双键,故A错误;
B.苯乙烯中C-H原子之间存在极性键,故B错误;
C.苯乙烯的分子式为分子式为C8H8,故C错误;
D.苯乙烯中含有碳碳双键,所以能发生加聚反应生成聚苯乙烯,故D正确;
故选D.
点评 本题考查有机物结构和性质,明确官能团与性质关系即可解答,侧重考查基本概念、烯烃、基本反应类型、化学键等知识点,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
2.下列化学反应先后顺序判断正确的是( )
| A. | 在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3 | |
| B. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含有等物质的量的NaCl、Na2S的溶液中加入AgN03溶液:NaCl、Na2S | |
| D. | 在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ |
7.下列各项中,表达正确的是( )
| A. | 乙烯的结构简式:C2H4 | B. | F原子结构示意图: | ||
| C. | NH3的结构式: | D. | HCl的电子式: |
4.氰氨化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN→CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )
| A. | CO为氧化产物,H2为还原产物 | B. | CaCN2含有共价键,属于共价化合物 | ||
| C. | HCN既是氧化剂又是还原剂 | D. | 每消耗10g CaCO3生成2.24L CO2 |
11.短周期主族元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为18.X原子半径比Y的小,Z是地壳中含量最高的元素,W与Z同主族.下列说法正确的是( )
| A. | 原子半径由小到大的顺序为:rW<rZ<rY | |
| B. | 简单离子氢化物的热稳定性Z>Y | |
| C. | X2W的沸点高于X2Z | |
| D. | 只含X、Y、W三种元素的化合物,不可能是离子化合物 |
1.某一不饱和酯类化合物(如图)在药物、涂料等领域应用广泛,下列有关说法不正确的是( )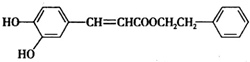
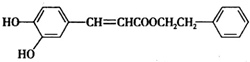
| A. | 能使KMnO4溶液褪色 | |
| B. | 1mol的该化合物和足量的钠反应生成1molH2 | |
| C. | 能与溴发生取代反应和加成反应 | |
| D. | 1mol该化合物最多与2molNaOH反应 |
8.下列离子方程式中,正确的是( )
| A. | 向AgCl悬浊液中加入KBr溶液:Ag++Br-=AgBr | |
| B. | 用铁棒作阴极、碳棒作阳极电解饱和氯化镁溶液:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O | |
| D. | 在强碱性溶液中NaClO与Fe(OH)3生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3═2FeO43-+3C1-+5H2O |
 ,黄绿色固体:
,黄绿色固体: ;
;