题目内容
14.下列关于离子化合物的叙述正确的是( )| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 含有共价键的化合物不可能是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
分析 含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,据此分析解答.
解答 解:A.含有离子键的化合物是离子化合物,所以离子化合物中都含有离子键,可能含有共价键,故A正确;
B.离子化合物中的阳离子不一定是金属离子,如铵盐,故B错误;
C.含有共价键的化合物可能是离子化合物,如铵盐、KOH等,故C错误;
D.溶于水可以导电的化合物可能是共价化合物,如HCl、硫酸等,故D错误;
故选A.
点评 本题考查化合物和化学键的关系,侧重考查基本概念、物质结构,明确物质的构成微粒即可判断,注意不能根据是否含有金属元素判断离子化合物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.右图表示容积固定的密闭容器中进行的某一可逆反应,A(g)+2B(g)?2C(g),以B的浓度变化表示的反应速率与时间的关系,已知速率的单位为mol/(L•s)图中阴影部分的数值相当于( )
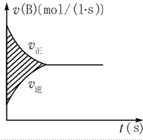

| A. | A浓度的减小量 | B. | B浓度的减小量 | ||
| C. | C物质的量的增加量 | D. | B物质的量的减少量 |
2.铝和铁是重要的金属元素,请回答下列问题:
Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为$\frac{22}{3}$,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
若在达平衡后的装置中继续加入A,B,C三种状况下的各物质,见上表:
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为$\frac{22}{3}$,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | Q |
| Fe | H2O(g) | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
9.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:
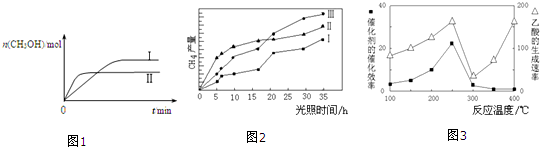
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H小于0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为0.4<b≤1.
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素.
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.

(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H小于0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素.
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
19.将3.84g铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体2.24L(标准状况下),则所消耗酸的物质的量是( )
| A. | 0.11mol | B. | 0.22mol | C. | 0.16mol | D. | 0.1mol |
6.下列物质中,不属于有机物的是( )
| A. | CCl4 | B. | CH3COOH | C. | CH3CH2OH | D. | CaCO3 |
