题目内容
19.右图表示容积固定的密闭容器中进行的某一可逆反应,A(g)+2B(g)?2C(g),以B的浓度变化表示的反应速率与时间的关系,已知速率的单位为mol/(L•s)图中阴影部分的数值相当于( )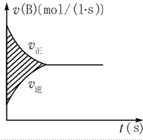
| A. | A浓度的减小量 | B. | B浓度的减小量 | ||
| C. | C物质的量的增加量 | D. | B物质的量的减少量 |
分析 由v=$\frac{△c}{△t}$可知,v正与t的乘积为浓度减小量,v逆与t的乘积为浓度增加量,以此分析图中阴影部分的面积.
解答 解:由v=$\frac{△c}{△t}$可知,v正与t的乘积为浓度减小量,v逆与t的乘积为浓度增加量,所以阴影部分的面积为正反应B的浓度减少与逆反应B的浓度增加的差,即为B浓度的减少,也等于C浓度的增加,为A浓度减少的2倍,
故选:B.
点评 本题考查图象和反应速率,明确速率与时间的乘积是解答本题的关键,注意把握反应中各物质的量之比的关系,题目难度不大.

练习册系列答案
相关题目
10.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH2COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
7.下列有关实验说法错误的是( )
| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通入足量的饱和NaHCO3溶液中除去SO2 | |
| C. | 用洁净的铂丝蘸取某食盐,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐中不含KIO3 | |
| D. | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由浅红色变成红色,冷却后溶液由红色变成淡红色,说明HCO3-在水溶液中存在水解平衡 |
14.下列说法正确的是( )
| A. | 直径为20nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步均为氧化还原反应 | |
| C. | 可溶性铁盐和铝盐可用作净水剂 | |
| D. | 光导纤维是一种新型硅酸盐材料 |
11.某污水处理厂欲对含有Fe2+的废水进行处理(测定发现该废水的pH接近6).某科研小组现拟定下列方案对该污水进行处理:向废水中加入一定量的过氧化氢溶液,同时用电动搅拌棒适当搅拌,使其产生难溶物沉降下来,已达到除去Fe2+的目的.
(1)科研小组为了研究影响上述方案的相关因素,在实验室中做了如表三组实验.请完成实验设计表(表中不要留空格):
(2)如表列出了Fe2+、Fe3+生成氢氧化物沉淀的pH值(开始沉淀的pH按照金属离子的物质的量浓度为0.01mol•L-1计算):
试写出废水中加入过氧化氢溶液搅拌时发生反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.Fe(OH)3的Ksp=1×10-37.4.该小组人员在实验中发现:若过氧化氢溶液加入过多,难溶物的沉降效果会变差,请分析原因:Fe3+可引起双氧水的分解产生氧气,大量的气泡影响了难溶物的沉降.
(3)小组人员发现:废水存放一段时间后,颜色发生了一定的变化.现取一定量的废水,对其中所含铁元素的存在形式进行研究.
①提出假设
假设一:只有Fe2+;
假设二:只有Fe3+;
假设三:两者都有.
②验证假设
为验证假设,请你设计一个实验方案,写出实验步骤、预期现象和结论:(限选试剂:稀HNO3溶液,稀NaOH溶液,KSCN溶液,KMnO4酸性溶液,淀粉KI溶液)
(1)科研小组为了研究影响上述方案的相关因素,在实验室中做了如表三组实验.请完成实验设计表(表中不要留空格):
| 编号 | 实验目的 | 污水的体积(mL) | 温度(℃) | 过氧化氢的质量分数 |
| ① | 为以下实验作参照 | 25 | 20 | 10% |
| ② | 过氧化氢浓度的影响 | 25 | 20 | 30% |
| ③ | 温度的影响 | 25 | 80 | 10% |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe2+ | 7.4 | 8.9 |
| Fe3+ | 2.2 | 3.2 |
(3)小组人员发现:废水存放一段时间后,颜色发生了一定的变化.现取一定量的废水,对其中所含铁元素的存在形式进行研究.
①提出假设
假设一:只有Fe2+;
假设二:只有Fe3+;
假设三:两者都有.
②验证假设
为验证假设,请你设计一个实验方案,写出实验步骤、预期现象和结论:(限选试剂:稀HNO3溶液,稀NaOH溶液,KSCN溶液,KMnO4酸性溶液,淀粉KI溶液)
| 实验步骤 | 预期现象及结论 |
| 第一步,取少量废水于试管中,滴加几滴KSCN溶液,振荡,观察现象. | 如果无现象,则假设一成立,如果溶液变红,则进行下一步实验 |
| 另取少量废水于试管中,滴加少量的KMnO4酸性溶液,振荡,观察现象 | 如果紫色退去,则假设三成立;如果紫色未退去,则假设二成立 |
8.利用太阳光能分解水制氢气是未来解决能源危机的理想方法之一.某研究小组设计了如图所示的循环系统实现光能分解水制氢气.反应过程中所需的电能由太阳光能电池提供,反应体系中I2和Fe3+等可循环使用.则下列有关结论中不正确的是( )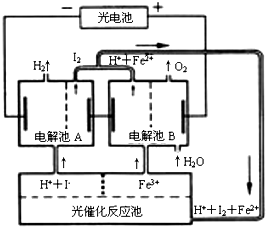

| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
14.下列关于离子化合物的叙述正确的是( )
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 含有共价键的化合物不可能是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
 一种有机化合物的结构简式为:
一种有机化合物的结构简式为: