题目内容
5.如图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
(1)写出木炭粉与浓硫酸反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(2)如果按装置中三部分仪器的连接顺序进行实验.
i.装置①出现无水硫酸铜变蓝现象说明有水生成;
ii.装置②中前一瓶品红溶液褪色,说明有SO2(或二氧化硫)生成;
iii.能检验出最后一种产物的现象是②中第二个品红溶液不褪色,③中澄清石灰水变浑浊
(3)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是H2O;不能确定的物质是CO2、SO2.
(4)若将①、②、③装置拆除,替换装置④进行实验.装置④中溶液颜色变浅绿色,其反应的离子方程式是SO2+2Fe3++2H2O═SO42-+2Fe2++4H+;反应后往④中溶液加入氯化钡溶液,反应的离子方程式是SO42-+Ba2+=BaSO4↓;
(5)若④中的氯化铁溶液含有少量的亚铁离子,为检验少量亚铁离子的存在,可选用的试剂是C;
A.KSCN溶液B.稀盐酸 C.KMnO4溶液D.NaOH溶液.
分析 (1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水,据此写出反应的化学方程式;
(2)i.装置①用无水硫酸铜检验水,无水硫酸铜变蓝说明有水生成;
ii.装置②中前一瓶品红溶液褪色证明混合气体中存在二氧化硫;
iii.检验二氧化碳气体时必须排除二氧化硫的干扰,即:②中第二个品红溶液不褪色,然后再根据③中澄清石灰水是否变浑浊判断;
(3)二氧化碳和二氧化硫均可以使澄清的石灰水变浑浊;
(4)铁离子与二氧化硫发生氧化还原反应生成硫酸根离子、亚铁离子和水,据此写出反应的离子方程式;反应后的溶液中含有硫酸根离子,加入氯化钡后生成硫酸钡沉淀;
(5)检验氯化铁溶液中的亚铁离子,不能使用硫氰化钾,可以利用亚铁离子的还原性,通过加入酸性高锰酸钾进行判断.
解答 解:(1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)i.装置①用于检验水,则无水硫酸铜变蓝说明有水生成,
故答案为:无水硫酸铜变蓝;水;
ii.二氧化硫检验漂白性,能够使品红溶液褪色,所以装置②中前一瓶品红溶液褪色证明混合气体中存在二氧化硫,
故答案为:SO2(或二氧化硫);
iii.二氧化硫和二氧化碳都能够使澄清石灰水变浑浊,当②中第二个品红溶液不褪色,证明二氧化硫已经除尽,若③中澄清石灰水变浑浊,则证明混合气体中存在二氧化碳气体,
故答案为:②中第二个品红溶液不褪色,③中澄清石灰水变浑浊;
(3)如果将仪器的连接顺序变为①、③、②,①可以确定水的存在,但是③既可以是二氧化碳的性质又可以是二氧化硫的性质,
故答案为:H2O;CO2、SO2;
(4)二氧化硫具有 还原性,能够与铁离子发生氧化还原反应,反应的离子方程式为:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+;反应后④的溶液中含有硫酸根离子,加入氯化钡后反应生成硫酸钡沉淀,反应的离子方程式为:SO42-+Ba2+=BaSO4↓,
故答案为:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+;SO42-+Ba2+=BaSO4↓;
(5)Fe2+具有还原性,能使酸性KMnO4溶液褪色,若④中的氯化铁溶液含有少量的亚铁离子,为检验少量亚铁离子的存在,可以使用酸性高锰酸钾溶液检验,而不能使用硫氰化钾溶液、稀盐酸和氢氧化钠,故C正确,
故答案为:C.
点评 本题考查了浓硫酸的性质,题目难度中等,注意掌握铜与浓硫酸反应的原理,明确常见气体的性质及检验方法,特别是加入试剂的先后顺序,(5)为易错点,注意溶液中含有铁离子,无法用硫氰化钾、氯水溶液检验亚铁离子.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH2COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
(1)科研小组为了研究影响上述方案的相关因素,在实验室中做了如表三组实验.请完成实验设计表(表中不要留空格):
| 编号 | 实验目的 | 污水的体积(mL) | 温度(℃) | 过氧化氢的质量分数 |
| ① | 为以下实验作参照 | 25 | 20 | 10% |
| ② | 过氧化氢浓度的影响 | 25 | 20 | 30% |
| ③ | 温度的影响 | 25 | 80 | 10% |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe2+ | 7.4 | 8.9 |
| Fe3+ | 2.2 | 3.2 |
(3)小组人员发现:废水存放一段时间后,颜色发生了一定的变化.现取一定量的废水,对其中所含铁元素的存在形式进行研究.
①提出假设
假设一:只有Fe2+;
假设二:只有Fe3+;
假设三:两者都有.
②验证假设
为验证假设,请你设计一个实验方案,写出实验步骤、预期现象和结论:(限选试剂:稀HNO3溶液,稀NaOH溶液,KSCN溶液,KMnO4酸性溶液,淀粉KI溶液)
| 实验步骤 | 预期现象及结论 |
| 第一步,取少量废水于试管中,滴加几滴KSCN溶液,振荡,观察现象. | 如果无现象,则假设一成立,如果溶液变红,则进行下一步实验 |
| 另取少量废水于试管中,滴加少量的KMnO4酸性溶液,振荡,观察现象 | 如果紫色退去,则假设三成立;如果紫色未退去,则假设二成立 |
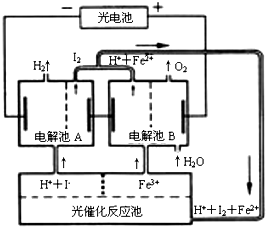
| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
Ⅰ火法炼铜 在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S=6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1 2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸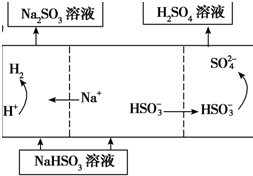 |
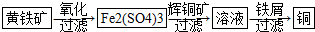
(1)Ⅱ相对于Ⅰ的优点是能大大降低能源消耗,利于减少污染或对贫矿、尾矿的开采更有价值.(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S=6Cu+SO2↑氧化剂是Cu2O、Cu2S
(3)已知CO的燃烧热283.0kJ•mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式S(g)+O2(g)═SO2(g)△H=-574.0kJ•mol-1
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为HSO3-+H2O-2e-=SO42-+3H+.
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=$\frac{\frac{42}{75}mol}{v×1{0}^{-3}L}$(可以写表达式)
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 含有共价键的化合物不可能是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |

 ;1124Na.
;1124Na.