��Ŀ����
9���о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����壮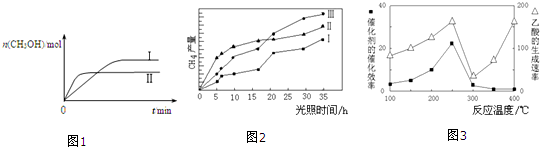
��1��CO��������������֪��Fe2O3��s��+3C��s���T2Fe��s��+3CO��g����H1=+489.0kJ•mol-1��C��s��+CO2��g���T2CO��g����H2=+172.5kJ•mol-1����CO��ԭFe2O3��s�����Ȼ�ѧ����ʽΪFe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5kJ•mol-1��
��2��CO��O2��Ƴ�ȼ�ϵ�أ���KOH��ҺΪ���Һ�����õ�صĸ�����ӦʽΪCO+4OH--2e-=CO32-+2H2O��
��3��CO2��H2����һ������ĺ����ܱ������У��������¶��·�����Ӧ��
CO2��g��+3H2��g��?CH3OH��g��+H2O��g�������CH3OH�����ʵ�����ʱ��ı仯��ͼ1��
�ٸ÷�Ӧ�ġ�HС��0������ڻ�С�ڡ���������I�����Ӧ��ƽ�ⳣ����С��ϵΪK����K���������=������
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�һ��ʱ���ﵽƽ�⣮
| �ݡ����� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol CO2��3mol H2 | a��mol CO2��3a��mol H2�� b��mol CH3OH��g����b��mol H2O��g�� |
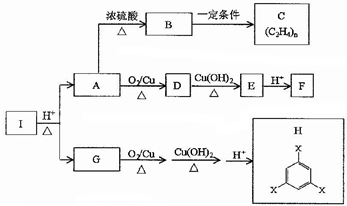
��4����TiO2/Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᣮ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ3��
�ٵ��¶���300�桫400�淶Χʱ���¶��������������ʵ���ҪӰ�����أ�
��Cu2Al2O4������ϡ���ᣬϡ���ỹԭ����ΪNO��д���йص����ӷ���ʽ3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
���� ��1�������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ����-�ڡ�3�õ���
��2��CO-O2ȼ�ϵ�أ���KOH��ҺΪ���Һ��������ԭ���ԭ��������ʧ���ӷ���������Ӧ��ȼ���ڸ���ʧ���ӷ���������Ӧ��
��3���ٸ���ͼ���֪���ߢ�ķ�Ӧ���ʴ����ߢ������ߢ��Ӧ���¶ȸ����ߢ��ߢ��Ӧ�ļ״������ʵ���С��Ҳ����˵�¶ȸ߷�Ӧƽ�������ƶ����ݴ��жϷ�Ӧ�ġ�H�������¶ȶ�ƽ���ƶ���Ӱ���֪�������¶ȣ�ƽ�������ȷ����ƶ����ݴ��ж�ƽ�ⳣ���ı仯��
����������ʽ�����ݵ�Чƽ���˼��ɴ�����ƽ��ʱ������̼ת����xmol��
�������� CO2��g��+3H2��g��?CH3OH��g��+H2O��g����
��ʼ1��mol����1 ���� 3 0 ���� 0
�仯1��mol����x 3x x x
ƽ��1��mol����1-x 3-3x x x
��ʼ2������ a 3a b b��
��4������ͼ��3��֪�����¶�300�桫400��ʱ���ߵ�б�ʱ仯�ϴ�Ҳ�����¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ��ϴ�
���Ƚ�Cu2Al2O4������������ʽ��Cu2O•Al2O3���ٸ������������ᷴӦ�������ӷ���ʽ����Ҫע�����һ��ͭ���л�ԭ�ԣ�
��� �⣺��1����Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H1=+489.0kJ•mol-1
��C��ʯī��+CO2��g��=2CO��g����H2=+172.5kJ•mol-1
���ݸ�˹���ɢ�-�ڡ�3�õ��Ȼ�ѧ����ʽΪ��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5 kJ•mol-1��
�ʴ�Ϊ��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5 kJ•mol-1��
��2��CO-O2ȼ�ϵ�أ���KOH��ҺΪ���Һ����һ����̼�ڸ���ʧ���ӷ���������Ӧ���ɶ�����̼����Һ������̼��أ�ԭ��ظ����缫��ӦΪ��CO+4OH--2e-=CO32-+2H2O���ʴ�Ϊ��CO+4OH--2e-=CO32-+2H2O��
��3���ٸ���ͼ���֪���ߢ�ķ�Ӧ���ʴ����ߢ������ߢ��Ӧ���¶ȸ����ߢ��ߢ��Ӧ�ļ״������ʵ���С��Ҳ����˵�¶ȸ߷�Ӧƽ�������ƶ����ݴ��жϷ�Ӧ�ġ�H��0�������¶ȶ�ƽ���ƶ���Ӱ���֪�������¶ȣ�ƽ�������ȷ����ƶ������÷�ӦΪ���ȷ�Ӧ�����������¶�ƽ�������ƶ���ƽ�ⳣ����С����K����K����
�ʴ�Ϊ��С�ڣ�����
����ƽ��ʱ������̼ת����xmol��
������������CO2��g��+3H2��g��?CH3OH��g��+H2O��g����
��ʼ1��mol����1 ���� 3 0 ���� 0
�仯1��mol����x 3x x x
ƽ��1��mol����1-x 3-3x x x
��ʼ2������ a 3a b b
���������֪��$\frac{x+x+1-x+3-3x}{1+3}$=0.8�����x=0.4��
���ݺ��º��������µĵ�Чƽ���˼�����п�ʼ1�Ϳ�ʼ2Ϊ��ȫ��Ч����a+b=1��Ҫʹ��Ӧʼ����������У���b��x����a�ķ�ΧΪС�ڵ���1����0.4��
�ʴ�Ϊ��0.4��b��1��
��4������ͼ��3��֪�����¶ȴ���300��ʱ���ߵ�б�ʱ仯�ϴ�Ҳ�����¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ��ϴʴ�Ϊ��300�桫400�棻
��Cu2Al2O4������������ʽ��Cu2O•Al2O3�����ᷴӦ�������ӷ���ʽ��3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
�ʴ�Ϊ��3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
���� ������Ҫ�������Ȼ�ѧ����ʽ����д���缫��Ӧ����д����ѧƽ��ļ��㼰������ԭ��Ӧ����ʽ����д���ۺ��Խ�ǿ����һ�����Ѷȣ�

| A�� | ֱ��Ϊ20nm������̼������ڽ��� | |
| B�� | ��ˮ����ȡþ�ĸ�����Ϊ������ԭ��Ӧ | |
| C�� | ���������κ����ο�������ˮ�� | |
| D�� | ���ά��һ���������β��� |
| A�� | ���ӻ������ж��������Ӽ� | |
| B�� | ���ӻ������е�������ֻ���ǽ������� | |
| C�� | ���й��ۼ��Ļ����ﲻ���������ӻ����� | |
| D�� | ����ˮ���Ե���Ļ�����һ�������ӻ����� |
| A�� | ��ϩ�ͼ�����һ�������¶�������������Ӧ | |
| B�� | ��ϩ�;���ϩ����ʹ������Ȼ�̼��Һ��ɫ | |
| C�� | ��ϩ�ͱ�����ʹ���Ը��������Һ��ɫ | |
| D�� | ��ϩ�����鶼���������������ӳɷ�Ӧ |

 ��
�� ��
�� ��
��
 ��D�Ľṹʽ��
��D�Ľṹʽ�� ��
�� ��
�� ��
��