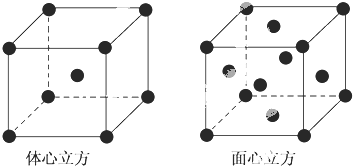
题目内容
2.铝和铁是重要的金属元素,请回答下列问题:Ⅰ、(1)铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为$\frac{22}{3}$,则反应的平衡常数K=16.
②下列说法正确的是B(填字母序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.恒温恒容平衡后,加入少量H2,再次平衡后,H2O(g)的体积分数减少
D.增加Fe3O4就能提高H2O的转化率
(3)若反就发生在恒容绝热的装置中,按下表充入起始物质,起始时与平衡后的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | Q |
| Fe | H2O(g) | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的体积分数由大到小的顺序排列:B>C>A(用A,B,C表示)
Ⅱ.离子液体是一室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
(1)钢制品应接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-.
(2)若改用AlCl3水溶液作电解液,则一段时间后不能生成AlO2-离子.(填能或不能)
分析 I.(1)根据盖斯定律,已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
(2)①根据相对分子质量计算混合气体中水、氢气的物质的量之比,由于反应前后气体体积不变,用物质的量代替浓度代入平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$计算;
②A.容器压强始终不变;
B.随反应进行气体质量减小,若容器内密度恒定,混合气体总质量不变,则反应达到平衡状态;
C.恒温恒容平衡后,加入少量H2,等效为增大压强,等效后的平衡与原平衡相比,平衡不移动;
D.增大固体的用量,不影响平衡移动;
(3)A中各物质的物质的量与原平衡起始各物质对应相等,但该容器为绝热,随反应进行温度与A相比发生变化,根据温度变化判断反应移动方向;
C中各物质的物质的量与原平衡状态对应相等,则C处于平衡状态;
B中转化到左边,Fe、水的物质的量与原平衡起始各物质对应相等,但该容器为绝热,根据反应热判断平衡时温度与原平衡温度高低,根据温度变化判断反应移动方向,进而判断氢气含量大小关系;
Ⅱ.(1)钢制品上电镀铝,铝做阳极,钢制品做阴极,阴极发生还原反应,为离子中+3价Al获得电子得到Al,电镀过程中不产生其他离子且有机阳离子不参与电极反应,由离子中Al与Cl原子比例关系,可知阴极上是Al2Cl7-得到电子生成Al与AlCl4-;
(2)改用AlCl3水溶液作电解液,阳极电极反应式为:2Al-6e-=2Al3+,阴极上是水电离的氢离子放电生成氢气、OH-,电极反应式为:6H2O+6e-=6OH-+3H2↑,生成的Al3+与OH-的物质的量之比为1:3.
解答 解:(1)已知:①3Fe(s)+2O2(g)?Fe3O4(s)△H 1=-1118.4KJ/mol;
②2H2(g)+O2(g)?2H2O(g)△H 1=-483.8KJ/mol;
③2H2(g)+O(g)?2H2O(l)△H 1=-571.8KJ/mol;
根据盖斯定律可知:①-②×2可得:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) 故△H=△H 1-2△H2)=(-1118.4kJ/mol)-2×(-483.8kJ/mol)=-150.8KJ/mol;
故答案为:-150.8KJ/mol;
(2)①在t℃时,该反应达到平衡状态测得混合气体平均相对分子质量为$\frac{22}{3}$,设水、氢气的物质的量分别为xmol、ymol,则$\frac{18x+2y}{x+y}$$\frac{22}{3}$,整理的x:y=1:2,由于反应前后气体体积不变,用物质的量代替浓度计算平衡常数,故平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$=$\frac{{2}^{4}}{{1}^{4}}$=16,
故答案为:16;
②A.该反应为气体体积不变的反应,所以容器内压强始终不变,不能用压强判断平衡状态,故A错误;
B.随反应进行气体质量减小,若容器内密度恒定,混合气体总质量不变,则反应达到平衡状态,故B正确;
C.恒温恒容平衡后,加入少量H2,等效为增大压强,等效后的平衡与原平衡相比,平衡不移动,平衡时水的体积分数不变,故C错误;
D.增大固体的用量,不影响平衡移动,不能提高H2O的转化率,故D错误,
故选:B;
(3)3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H=-150.8KJ/mol,正反应是体积不变的放热反应,
A中各物质的物质的量与原平衡起始各物质对应相等,但该容器为绝热,随反应进行温度升高,与原平衡对比,相当于在原平衡的基础上升高温度,平衡逆向移动,氢气的体积分数比原平衡的小;
C中各物质的物质的量与原平衡状态对应相等,则C处于平衡状态,氢气体积发生等于原平衡的;
B中转化到左边,Fe、水的物质的量与原平衡起始各物质对应相等,但该容器为绝热,该反应逆向进行建立平衡,平衡时的温度小于原平衡,与原平衡相比,相当于在原平衡的基础上降低温度,平衡正向移动,氢气的体积分数比原平衡的大,
故氢气体积分数:B>C>A,
故答案为:B>C>A;
Ⅱ.(1)钢制品上电镀铝,铝做阳极,连接电源的正极,钢制品做阴极,连接电源的负极,阴极发生还原反应,为离子中+3价Al获得电子得到Al,电镀过程中不产生其他离子且有机阳离子不参与电极反应,由离子中Al与Cl原子比例关系,可知阴极上是Al2Cl7-得到电子生成Al与AlCl4-,阴极电极反应式为:4Al2Cl7-+3e-=Al+7AlCl4-,
故答案为:负;4Al2Cl7-+3e-=Al+7AlCl4-;
(2)改用AlCl3水溶液作电解液,阳极电极反应式为:2Al-6e-=2Al3+,阴极上是水电离的氢离子放电生成氢气、OH-,电极反应式为:6H2O+6e-=6OH-+3H2↑,生成的Al3+与OH-的物质的量之比为1:3,反应恰好生成Al(OH)3,没有AlO2-离子生成,
故答案为:不能.
点评 本题属于拼合型题目,涉及反应热计算、化学平衡计算、化学平衡移动、平衡状态判断、电解原理及电极反应式书写等,I(3)中注意为绝热容器,随反应进行,温度发生变化,II(2)为易错点,学生容易考虑铝离子与氢氧根离子反应可以生成偏铝酸根,忽略量的问题.

| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通入足量的饱和NaHCO3溶液中除去SO2 | |
| C. | 用洁净的铂丝蘸取某食盐,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐中不含KIO3 | |
| D. | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由浅红色变成红色,冷却后溶液由红色变成淡红色,说明HCO3-在水溶液中存在水解平衡 |
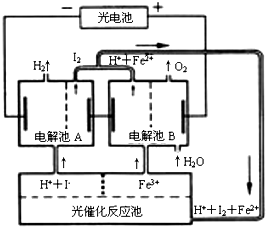
| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
Ⅰ火法炼铜 在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S=6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1 2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸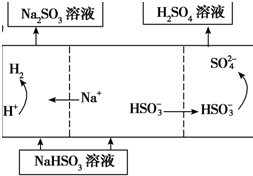 |
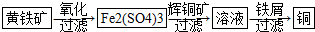
(1)Ⅱ相对于Ⅰ的优点是能大大降低能源消耗,利于减少污染或对贫矿、尾矿的开采更有价值.(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S=6Cu+SO2↑氧化剂是Cu2O、Cu2S
(3)已知CO的燃烧热283.0kJ•mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式S(g)+O2(g)═SO2(g)△H=-574.0kJ•mol-1
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为HSO3-+H2O-2e-=SO42-+3H+.
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=$\frac{\frac{42}{75}mol}{v×1{0}^{-3}L}$(可以写表达式)
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 含有共价键的化合物不可能是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |

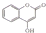 ,常用于制备抗凝血药,可通过下列流程合成:
,常用于制备抗凝血药,可通过下列流程合成:
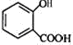 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$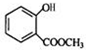 +H2O.
+H2O.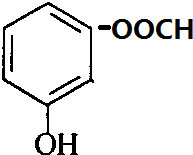 、
、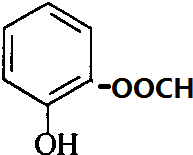 、
、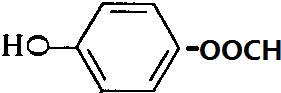 .
.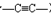 )组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )
)组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )