题目内容
4.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.请回答下列问题:(1)Y 元素的名称硅;
(2)W 在元素周期表中的位置是第三周期第VIIA族;
(3)X2M2 中存在的化学键有离子键、共价键;
(4)Z、W氢化物的稳定性顺序为HCl>H2S.
分析 Y的单质晶体熔点高、硬度大,是一种重要的半导体材料可知Y为Si,则X、Y、Z、W都在第三周期,再由X+与M2-具有相同的电子层结构;离子半径:Z2->W-;依次推出X为Na,M为O,Z为S,W为Cl,据此解答各小题即可.
解答 解:依据分析可知:X为钠,Y为硅,Z为硫,W为氯,M为氧,
(1)Y为Si,名称是:硅,故答案为:硅;
(2)W为Cl,Cl有3个电子层,最外层电子数为7,故位于第三周期第ⅦA族,故答案为:三;VIIA;
(3)X2M2 为Na2O2 中存在钠离子与过氧根离子形成的离子键,过氧根中存在O-O非极性共价键,故答案为:离子键、共价键;
(4)元素的非金属性越强,其气态氢化物越稳定,由于非金属性Cl>S,故答案为:HCl>H2S.
点评 本题考查位置、结构、性质的关系和应用,寻找本题的突破点为Y是解答本题的关键,然后利用元素化合物知识来解答即可.

练习册系列答案
 能力评价系列答案
能力评价系列答案
相关题目
14.下列关于离子化合物的叙述正确的是( )
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 含有共价键的化合物不可能是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
9.下列实验操作中正确的是( )
| A. | 用湿润的pH试纸测定某稀醋酸溶液的pH | |
| B. | 做完银镜反应的试管可以用氨水来洗涤 | |
| C. | 为了除去苯中混有的少量苯酚,加入足量浓溴水,充分搅拌后过滤分离 | |
| D. | 如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 |
13.4p轨道填充一半电子的元素,其原子序数是( )
| A. | 15 | B. | 33 | C. | 35 | D. | 20 |
14.如图表示4-溴环己烯所发生的4个不同反应;其中,产物只含有一种官能团的反应是( )
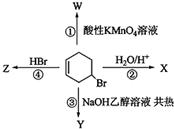

| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
 ;1124Na.
;1124Na.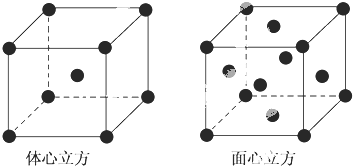
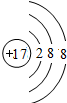 、
、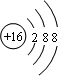 ;
;