题目内容
6.下列物质中,不属于有机物的是( )| A. | CCl4 | B. | CH3COOH | C. | CH3CH2OH | D. | CaCO3 |
分析 有机物是指含有碳元素的化合物.无机物是指不含有碳元素的化合物.一氧化碳、二氧化碳、碳酸盐等物质中虽然含有碳元素,但是这些物质的性质和无机物相似,把它们归入无机物.
解答 解:A.CCl4是含有碳元素的化合物,属于有机物,故A错误;
B.CH3COOH是含有碳元素的化合物,属于有机物,故B错误;
C.CH3CH2OH是含有碳元素的化合物,属于有机物,故C错误;
D.CaCO3虽然含有碳元素,但是CaCO3的性质和无机物相似,属于无机物,故D正确.
故选D.
点评 本题考查有机物和无机物的区别,难度不大,掌握有机物与无机物的概念、特征等是正确解答此类题的关键.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
11.某污水处理厂欲对含有Fe2+的废水进行处理(测定发现该废水的pH接近6).某科研小组现拟定下列方案对该污水进行处理:向废水中加入一定量的过氧化氢溶液,同时用电动搅拌棒适当搅拌,使其产生难溶物沉降下来,已达到除去Fe2+的目的.
(1)科研小组为了研究影响上述方案的相关因素,在实验室中做了如表三组实验.请完成实验设计表(表中不要留空格):
(2)如表列出了Fe2+、Fe3+生成氢氧化物沉淀的pH值(开始沉淀的pH按照金属离子的物质的量浓度为0.01mol•L-1计算):
试写出废水中加入过氧化氢溶液搅拌时发生反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.Fe(OH)3的Ksp=1×10-37.4.该小组人员在实验中发现:若过氧化氢溶液加入过多,难溶物的沉降效果会变差,请分析原因:Fe3+可引起双氧水的分解产生氧气,大量的气泡影响了难溶物的沉降.
(3)小组人员发现:废水存放一段时间后,颜色发生了一定的变化.现取一定量的废水,对其中所含铁元素的存在形式进行研究.
①提出假设
假设一:只有Fe2+;
假设二:只有Fe3+;
假设三:两者都有.
②验证假设
为验证假设,请你设计一个实验方案,写出实验步骤、预期现象和结论:(限选试剂:稀HNO3溶液,稀NaOH溶液,KSCN溶液,KMnO4酸性溶液,淀粉KI溶液)
(1)科研小组为了研究影响上述方案的相关因素,在实验室中做了如表三组实验.请完成实验设计表(表中不要留空格):
| 编号 | 实验目的 | 污水的体积(mL) | 温度(℃) | 过氧化氢的质量分数 |
| ① | 为以下实验作参照 | 25 | 20 | 10% |
| ② | 过氧化氢浓度的影响 | 25 | 20 | 30% |
| ③ | 温度的影响 | 25 | 80 | 10% |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe2+ | 7.4 | 8.9 |
| Fe3+ | 2.2 | 3.2 |
(3)小组人员发现:废水存放一段时间后,颜色发生了一定的变化.现取一定量的废水,对其中所含铁元素的存在形式进行研究.
①提出假设
假设一:只有Fe2+;
假设二:只有Fe3+;
假设三:两者都有.
②验证假设
为验证假设,请你设计一个实验方案,写出实验步骤、预期现象和结论:(限选试剂:稀HNO3溶液,稀NaOH溶液,KSCN溶液,KMnO4酸性溶液,淀粉KI溶液)
| 实验步骤 | 预期现象及结论 |
| 第一步,取少量废水于试管中,滴加几滴KSCN溶液,振荡,观察现象. | 如果无现象,则假设一成立,如果溶液变红,则进行下一步实验 |
| 另取少量废水于试管中,滴加少量的KMnO4酸性溶液,振荡,观察现象 | 如果紫色退去,则假设三成立;如果紫色未退去,则假设二成立 |
14.下列关于离子化合物的叙述正确的是( )
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 含有共价键的化合物不可能是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
18.下列关于有机物性质的说法正确的是( )
| A. | 乙烯和甲烷在一定条件下都可以与氯气反应 | |
| B. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| C. | 乙烯和苯都能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯和乙烷都可以与氢气发生加成反应 |

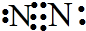 ,D的结构式:
,D的结构式: .
. )组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )
)组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )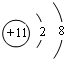 ;1124Na.
;1124Na.