题目内容
10.聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m.取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份.一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.1650g.另一份溶液,先将Fe3+还原为Fe2+,再用0.0200mol•L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液33.33mL.该聚合硫酸铁样品中a:b的比值为(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O).( )| A. | 2:1 | B. | 3:1 | C. | 1:1 | D. | 4:5 |
分析 加入氯化钡生成的沉淀为硫酸钡,可计算出硫酸根离子的物质的量,根据Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O和滴定所用重铬酸钾的量可计算出铁离子的物质的量,根据电荷守恒可计算出氢氧根离子的物质的量,铁和氢氧根离子的物质的量之比即为a:b的比值
解答 解:n(SO42-)=$\frac{1.1650g}{233g/mol}$=0.005mol,n(K2Cr2O7)=0.03333L×0.02mol/=0.0006666mol,
n(Fe2+)=n(K2Cr2O7)×6=0.0039996mol,
由电荷守恒可知n(OH-)+n(SO42-)×2=n(Fe3+)×3,n(OH-)=0.0039996mol×3-0.005mol×2=0.0019988mol,
得到a:b=0.0039996mol:0.0019988mol=2:1,故选A.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,计算的关键是搞清反应原理,灵活运用中和滴定的数据计算铁的物质的量,利用电荷守恒来计算氢氧根离子的物质的量.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
1.下列关于常见有机物的说法正确的是( )
| A. | 分子式为C4H8的有机物有3种同分异构体(不考虑立体异构) | |
| B. | 汽油、煤油、柴油、甘油结构相似,性质相似 | |
| C. | -C(CH3)3的系统命名为1,1-二甲基乙基 | |
| D. | 聚乙烯塑料老化是因为发生了加成反应 |
18.O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点.O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力.常温常压下发生反应如下:
反应①O3?O2+[O]△H>0 平衡常数为K1;
反应②[O]+O3?2O2△H<0 平衡常数为K2;
总反应:2O3?3O2△H<0 平衡常数为K
下列叙述正确的是( )
反应①O3?O2+[O]△H>0 平衡常数为K1;
反应②[O]+O3?2O2△H<0 平衡常数为K2;
总反应:2O3?3O2△H<0 平衡常数为K
下列叙述正确的是( )
| A. | 升高温度,K增大 | B. | K=K1+K2 | ||
| C. | 适当升温,可提高消毒效率 | D. | 压强增大,K2减小 |
5.如图是一些常见有机物的转化关系,下列说法正确的是( )
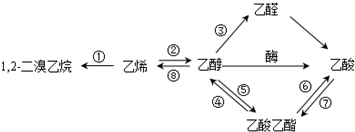

| A. | 反应①是加成反应,反应⑧是消去反应,其它所标明的反应都是取代反应 | |
| B. | 上述物质中能与NaOH溶液反应的只有乙酸 | |
| C. | 1,2一二溴乙烷、乙烯、乙醇烃基上的氢被氯取代,其一氯取代产物都是一种 | |
| D. | 等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同 |
15.利用下列实验装置进行的相应实验,能达到实验目的是( )
| A. |  所示装置可制备氨气 | |
| B. |  所示装置可分离CH3CH2OH和CH3COOC2H5的混合液 | |
| C. |  所示装置可制备、收集乙烯并验证其易被氧化 | |
| D. |  所示装置可制取乙酸乙酯 |
2.化学与社会、生活密切相关,下列说法正确的是( )
| A. | Fe3O4俗称铁红,常做红色油漆和涂料 | |
| B. | 燃料电池的燃料都在负极发生氧化反应 | |
| C. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
20.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 常温下,0.1mol•L-1的①NH4Cl ②CH3COONH4 ③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③ | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO${\;}_{3}^{-}$)+2c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |