题目内容
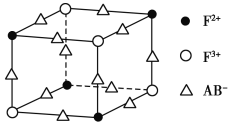
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。

(1)由图中所给数据进行分析,该反应的化学方程式为___;
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=___;
(3)当反应进行了3 min,该反应是否达到平衡___(填是或否);
(4)____时间段正逆反应速率相等;
(5)平衡体系中Y的百分含量(体积比)为___。
【答案】3X+Y![]() 2Z 0.05mol/(L·min) 是 2min后 50%
2Z 0.05mol/(L·min) 是 2min后 50%
【解析】
根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;根据c=![]() 计算反应速率;当反应进行到2min时各物质的量不随时间的改变而改变,反应达平衡状态。
计算反应速率;当反应进行到2min时各物质的量不随时间的改变而改变,反应达平衡状态。
(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y![]() 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y![]() 2Z;
2Z;
(2)反应开始至2min时Z的平均反应速率为:c(Z)= =0.05mol/(Lmin),故答案为:0.05mol/(Lmin);
=0.05mol/(Lmin),故答案为:0.05mol/(Lmin);
(3)当反应进行到2min时各物质的量不随时间的改变而改变,反应达平衡状态,而后面一直维持平衡状态,故答案为:是;
(4)当反应进行到2min时各物质的量不随时间的改变而改变,反应达平衡状态,故答案为:2min后;
(5)当反应进行到2min时,达到平衡状态,各组分的浓度不随时间的变化而变化,若三种物质都是气体,平衡时Y所占体积的百分比为![]() ×100%=50%,故答案为:50%。
×100%=50%,故答案为:50%。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目